Anvendelse af kameldyr-antistoffer til strukturbiologi
Brug af antistoffer fra kameldyr giver bedre muligheder for fremtidig udvikling af reagenser til diagnosticering og terapi i sygdomme, der involverer en gruppe enzymer kaldet serinproteaser.
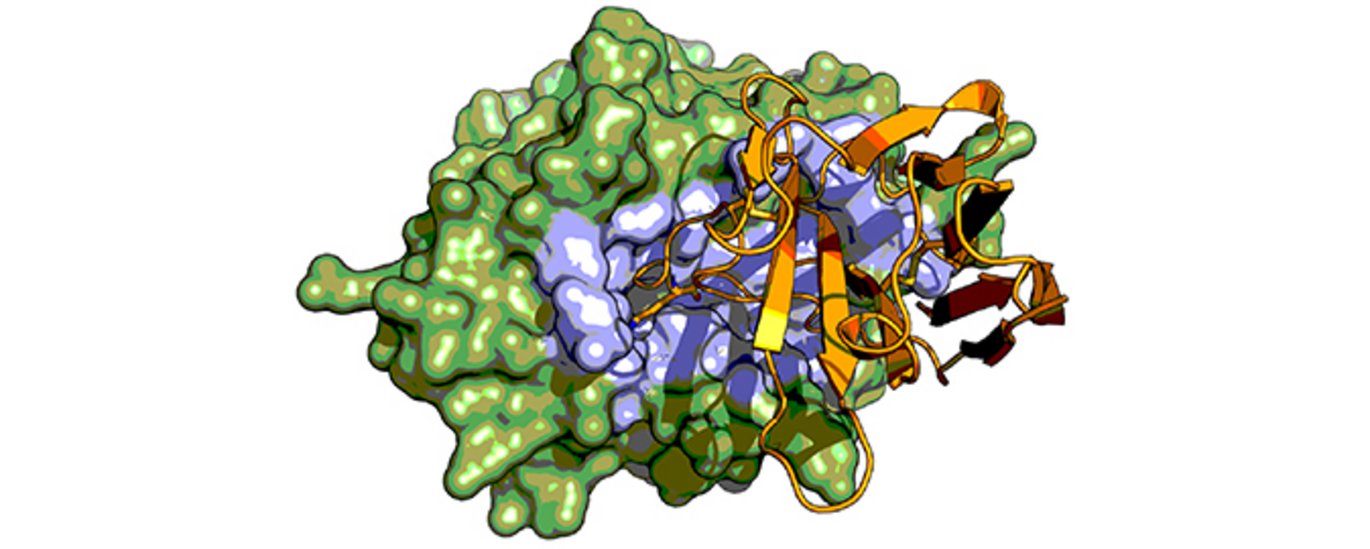
Antistoffer har mange anvendelsesmuligheder, i områder der spænder lige fra grundlæggende molekylærbiologi og biokemi til klinisk medicin. For nyligt har der været meget interesse omkring en særlig gruppe af antistoffer fra kameldyr (kameler, dromedarer, lamaer). Dette skyldes, at disse antistoffer på grund af deres lille størrelse og unikke struktur er ideelle til at producere nye biologiske lægemidler, der har flere fordele frem for andre terapeutiske molekyler. Derudover har disse antistoffer mange andre tekniske anvendelser inden for grundlæggende biokemi og strukturel biologi.
Nu har en gruppe af danske, belgiske, og kinesiske forskere anvendt kameldyrsantistoffer til at udforske grundlæggende principper for katalyse og hæmning af en gruppe enzymer kaldet serinproteaser ved hjælp af røntgenkrystalstrukturanalyse. Serinproteaser katalyserer vigtige processer i blodkoagulation, sårheling, vævsombygning og andre fysiologiske funktioner.
Forskerholdet har udviklet kameldyrsantistoffer mod serinproteaser, som muliggør en strukturel karakterisering af et problem, der har været kendt længe, nemlig om hvorvidt et bestemt peptidsegment vil opføre sig som en inhibitor eller et substrat for en serinprotease. Resultaterne har også stor betydning for den fremtidige udvikling af reagenser til diagnosticering og terapi i sygdomme, der involverer serinproteaser.
Resultaterne er opnået i et samarbejde mellem forskere fra Aarhus, Leuven og Bruxelles i Belgien og Hong Kong, Kina. Serge Muyldermans, Vrijes Universiteit Bruxelles, der var banebrydende for udviklingen af kameldyrsantistofteknologien, har ydet et særligt bidrag med sin ekspertise. Tobias-Kromann-Hansen tilbragte fire måneder af sit ph.d.-studium i Muyldermans laboratorium. Tobias Kromann-Hansen er nu ved at udvikle disse studier yderligere som Carlsberg Postdoc Research Fellow ved University of California i San Diego, USA. Resultaterne er offentliggjort i Journal of Biological Chemistry. Publikationen er et af resultaterne fra Danish-Chinese Centre for Proteases and Cancer, ledet af Peter A. Andreasen.
A Camelid-derived antibody fragment targeting the active site of a serine protease balances between inhibitor and substrate behavior. Kromann-Hansen, T., Oldenburg, E., Yung, K.W.Y, Ghassabeh, G.H., Muyldermans, S., Declerck, P.J., Huang, M., Andreasen, P.A., and Ngo, J.C.K. (2016) J. Biol. Chem.
http://www.jbc.org/content/early/2016/05/23/jbc.M116.732503.full.pdf
Mere information
Professor, dr. scient. Peter A. Andreasen
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
pa@mbg.au.dk – mobil: 23492837
