Overraskende ny mekanisme til regulering af genekspression
Nye forskningsresultater har løftet sløret for en ny funktion i regulering af genekspression hos et protein, der ellers er kendt for at spille en rolle for funktionen af neuroner. Videre analyser af dette proteins virkemåde kan på længere sigt føre til forståelse af, hvordan neurologiske defekter kan opstå som følge af abnormiteter i dette protein.

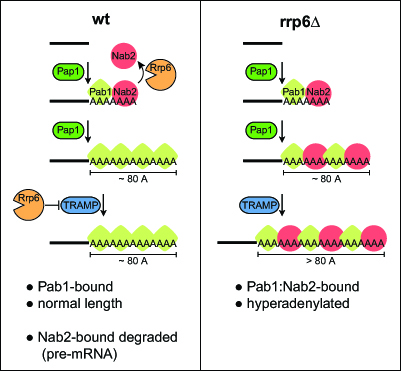
Forskerne har undersøgt et protein, Nab2, der findes i almindeligt bagegær. Den menneskelige version af Nab2 proteinet, kaldet ZC3H14, kræves for normal funktion af neuroner, og mutationer i genet for ZC3H14 er knyttet til den arvelige sygdom NS-ARID, der medfører mental retardering allerede i barnealderen. Studierne fra gærcellerne kan muligvis fortælle noget om, hvordan menneskeproteinet fungerer, og derfor i det lange perspektiv give information om, hvordan ændringer i genekspression kan medføre neurologiske defekter.
Forskningsresultaterne er lige blevet publiceret online i det prestigiøse amerikanske tidsskrift Molecular Cell. Arbejdet er udført i samarbejde med forskere fra Tufts University School of Medicine, Boston, det Europæiske Molekylærbiologiske Laboratorium EMBL i Heidelberg og det danske grundforskningscenter ”Centre for mRNP Biogenesis and Metabolism” ved Institut for Molekylærbiologi og Genetik, Aarhus Universitet
Baggrundsinformation
Alle levende celler er små fabrikker, der konstant producerer nye proteiner og genbruger gamle. Information om arten og mængden af producerede proteiner er kodet i en celles genom og afkodet til proteiner i en kompleks kæde af et forløb betegnet "genekspression". Mængden af proteiner, der skal produceres af individuelle celler varierer meget afhængig af celletype og vækstbetingelser. Celler udøver derfor streng kontrol med genekspressionprocessen.
Den nye undersøgelse har opdaget et ny reguleringsprincip til styring af genekspression, der er rettet mod den såkaldte ”budbringer” (messenger) RNA (mRNA), som er en kopi af den genomiske information, der fungerer som en skabelon for proteinsyntese. Derfor er kontrol med mængden af mRNA et vigtigt redskab til at styre, hvor meget protein der produceres i en celle, og derfor også et redskab til at regulere cellens stofskifte.
mRNA’en er et langt lineært molekyle, som indeholder et bestemt mærke ved sin bageste ende, den såkaldte poly(A)-hale. Denne række adenosinrester adskiller mRNA fra andre typer af cellulært RNA, og er specielt vigtig i forbindelse med udvælgelsen af mRNA'er til protein-producerende fabrikker. mRNA’er produceres og nedbrydes konstant, og mængden af ??mRNA til stede i en celle bestemmes af balancen mellem produktion og nedbrydning.
De nye resultater
I den ny undersøgelse fandt forskerne en uventet funktion af proteinet Nab2. Det har tidligere været antaget, at Nab2 kun var nødvendigt for at beskytte mRNA’s poly(A) haler og for cellulær transport af mRNA. Den ny forskning viser imidlertid klart, at Nab2 også kan fungere ved at dirigere umodne mRNA til nedbrydning, hvis de er blevet fejlagtigt tilbageholdt i cellekernen og derfor ikke kan deltage i proteinsyntese.
Denne proces er således på den ene side en ny type kvalitetskontrolforanstaltning, der fjerner dysfunktionelle RNA'er, og på den anden side også en mekanisme, der kan udnyttes af cellen til at regulere genekspression.
Næste skridt
Den fremtidige forskningsindsats vil nu blive sat ind på at udforske i detaljer, hvilke former for forskellige cellulære RNA’er der er modtagelige for regulering ved Nab2. Her håber forskerne, at kunne afsløre hemmeligheder om Nab2’s berømte menneskelige fætter ZC3H14, der kan føre til en forståelse for, hvordan skader på nerveceller opstår.
Forskningsprojektet er udført af senior-postdoc Manfred Schmid sammen med ph.d.-studerende Mathias Bach Poulsen og Pawel Olszewski fra Torben Heick Jensens laboratorium ved Institut for Molekylærbiologi og Genetik, Aarhus Universitet, i et samarbejde med forskere fra Tufts University, Boston, USA, og fra the European Molecular Biology Laboratory (EMBL), Heidelberg, Tyskland.
Mere information
Professor Torben Heick Jensen
Leder af Center for mRNP Biogenese og Metabolisme
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
thj@mb.au.dk - 60202705 - http://www.mRNP.dk.
Tekst: Manfred Schmid og Lisbeth Heilesen
Oversættelse: Lisbeth Heilesen
