Symbiose mellem et "parasitgen" og dets vært
Et dansk forskerhold har beskrevet en kompleks symbiose mellem et "snyltende" ikke-kodende RNA-gen og dets proteinkodende værtsgen i humane celler. Undersøgelsen afslører, hvordan co-evolution af værts- og parasitgen har medført en feedback-mekanisme, hvori parasitgenet indtager en helt ny og overraskende rolle som hovedregulator af værtsgenets proteinproduktion. Med disse opdagelser åbnes et helt nyt forskningsområde op inden for geners omsætning til proteiner.
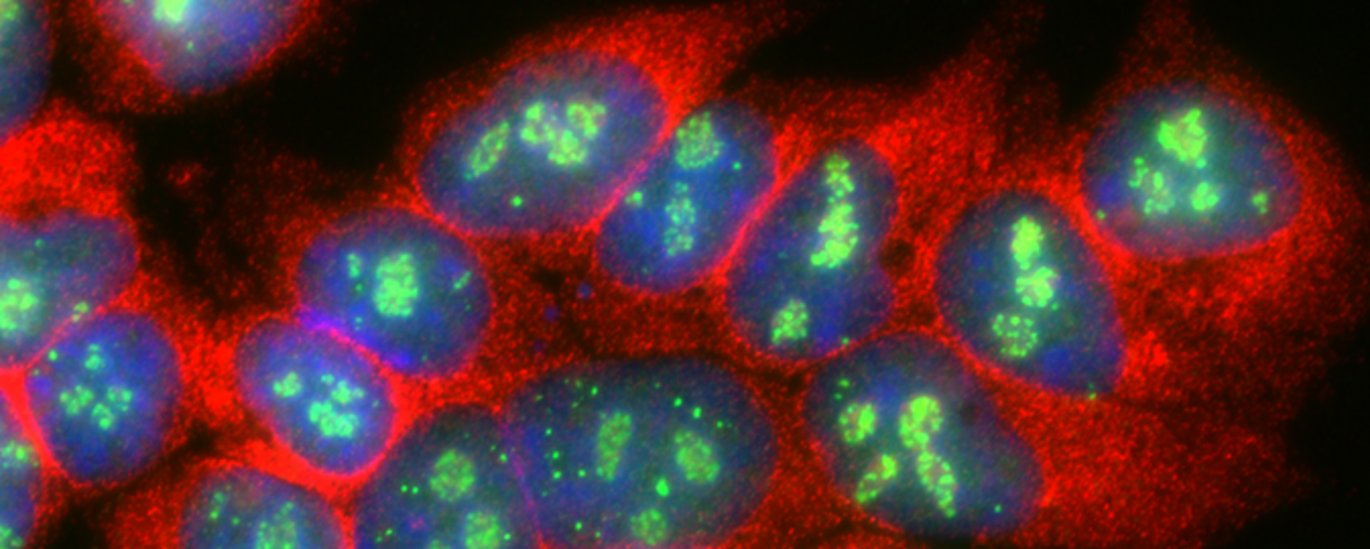

Der findes mange forskellige typer RNA’er i menneskeceller, som ikke har den almen kendte funktion at fungere som ”opskrift” for produktionen af proteiner. Disse kaldes for ikke-kodende RNA’er og har til opgave at udføre andre jobs, der er vigtige for cellernes sundhed og funktion. En gruppe af sådanne RNA’er er de såkaldte små snoRNA'er, som befinder sig i cellens kerne. Her udfører de en vigtig funktion som assistenter i produktionen af andre typer ikke-kodende RNA’er, mere specifikt de protein-producerende fabrikker kendt som ribosomerne. snoRNA’er kan guide foldning og modning af ribosomerne ved at ændre på kemiske grupper i det ribosomale RNA. Dette job udføres i samarbejde med forskellige proteiner som både hjælper snoRNA’et med at finde det RNA, der skal hjælpes, samt udføre den kemiske ændring på meget specifikke placeringer.
snoRNA’s funktion er opstået tidligt i evolutionen og findes i både arkæer og eukaryote celler. Selvom deres funktion og struktur er bevaret igennem evolutionen, er produktionen af snoRNA’er meget alsidig i forskellige celletyper. I mennesker er størstedelen af snoRNA-gener placeret i højt udtrykte protein-kodende eller ikke-kodende værtsgener, hvor snoRNA’er er placeret i de dele af værtsgenerne, som kaldes for introns; elementer i værtsgenet som ekskluderes under syntesen af det færdige RNA. Denne proces kaldes for splicing og betyder, at snoRNA-produktionen er afhængig af værtsgenets produktion.
Overraskende rolle for ”parasitgen”
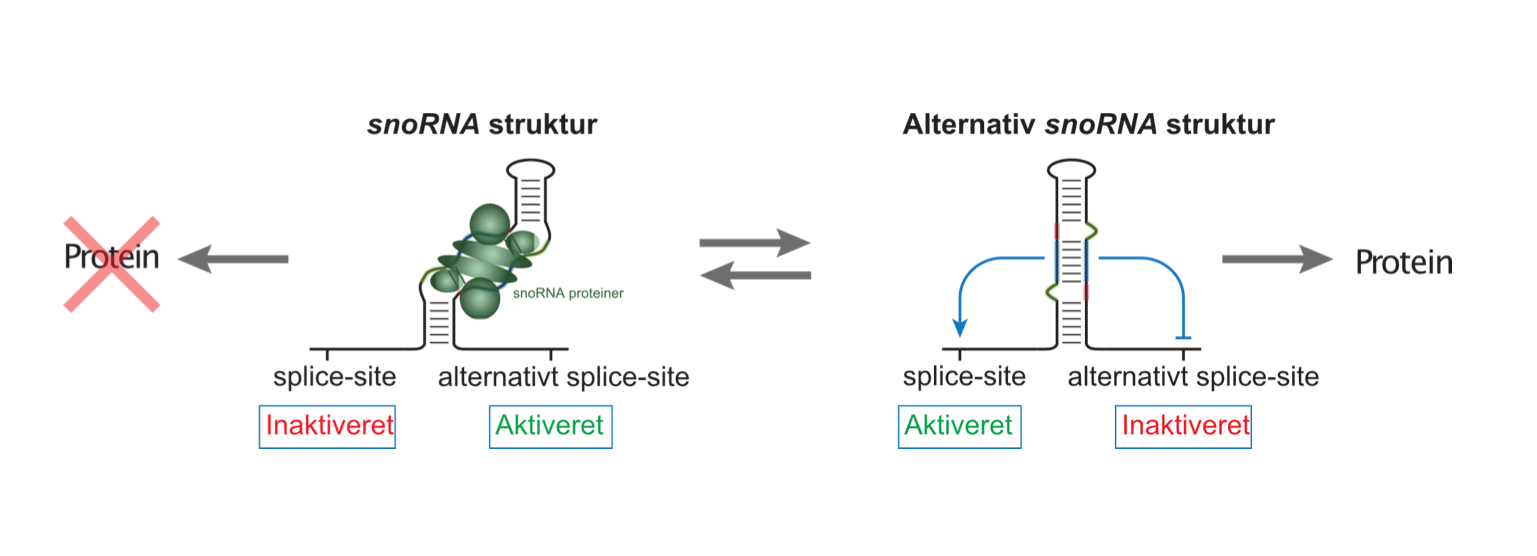
Da forskergruppen undersøgte sådanne snoRNA værtsgener, identificerede de et særligt snoRNA, som overraskende viste sig at have et alternativt snoRNA-baseret job i cellen. De fandt, at i stedet for at assistere ribosomal produktion fungerer dette snoRNA som en sensor og hovedkontakt for reguleringen af værtsgenet, som koder for et snoRNA-bindende protein, der er nødvendig for den generelle snoRNA funktion (Figur 1).
Resultaterne understøtter en model hvor snoRNA’et igennem strukturelle ændringer kan regulere splicingsprocessen af værtsgenet. Ved høje snoRNA-proteinniveauer vil snoRNA -strukturen medføre en alternativ splicing af RNA’et fra værtsgenet, som ultimativt vil forhindre yderligere produktion af snoRNA-protein. Omvendt vil mangel på snoRNA-proteiner medføre en anderledes snoRNA-struktur under genexpression, som medfører øget snoRNA-proteinproduktion.
Den afdækkede feedback-mekanisme sikrer en præcis koordinering mellem snoRNA-proteiner og globale snoRNA-niveauer, hvilket i sidste ende sikrer, at andre livsvigtige RNA’er kan modificeres og produceres korrekt. Misreguleringer af disse vigtige ikke-proteinkodende RNA’er er ofte associeret med forskellige kræftformer og sygdomsudvikling, hvilket understreger behovet for en dybere forståelse af cellens strategier for at opretholde strikte niveauer af funktionelle snoRNA-proteinkomplekser.
Derudover viser denne forskning i høj grad, at snoRNA-parasitgener placeret i værtsgener igennem evolutionen har muliggjort nye og vigtige roller (Figur 2). Derved åbnes et helt nyt forskningsområde op, hvor eventuelle andre snoRNA-regulerede cellulære mekanismer kan findes.
Den videnskabelige artikel er netop offentliggjort i det internationale tidsskrift Molecular Cell:
Box C/D snoRNP Autoregulation by a cis-Acting snoRNA in the NOP56 Pre-mRNA:
Søren Lykke-Andersen, Britt Kidmose Ardal, Anne Kruse Hollensen, Christian Kroun Damgaard & Torben Heick Jensen
https://doi.org/10.1016/j.molcel.2018.08.017
Mere information
Søren Lykke-Andersen – sla@mbg.au.dk – 87154962
Britt Kidmose Ardal – ardal@mbg.au.dk
Torben Heick Jensen – thj@mbg.au.dk – 60202705
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
