Gennembrud i udforskningen af proteiners dynamik
Ved hjælp af en enestående informativ teknologi har et dansk forskerhold opdaget en ny type peptidkæde dynamik, der styrer proteinet PAI-1s stabilitet. Fundet giver bedre basis for på længere sigt at gribe ind mod sygdomme forbundet med øget risiko for blodpropper.
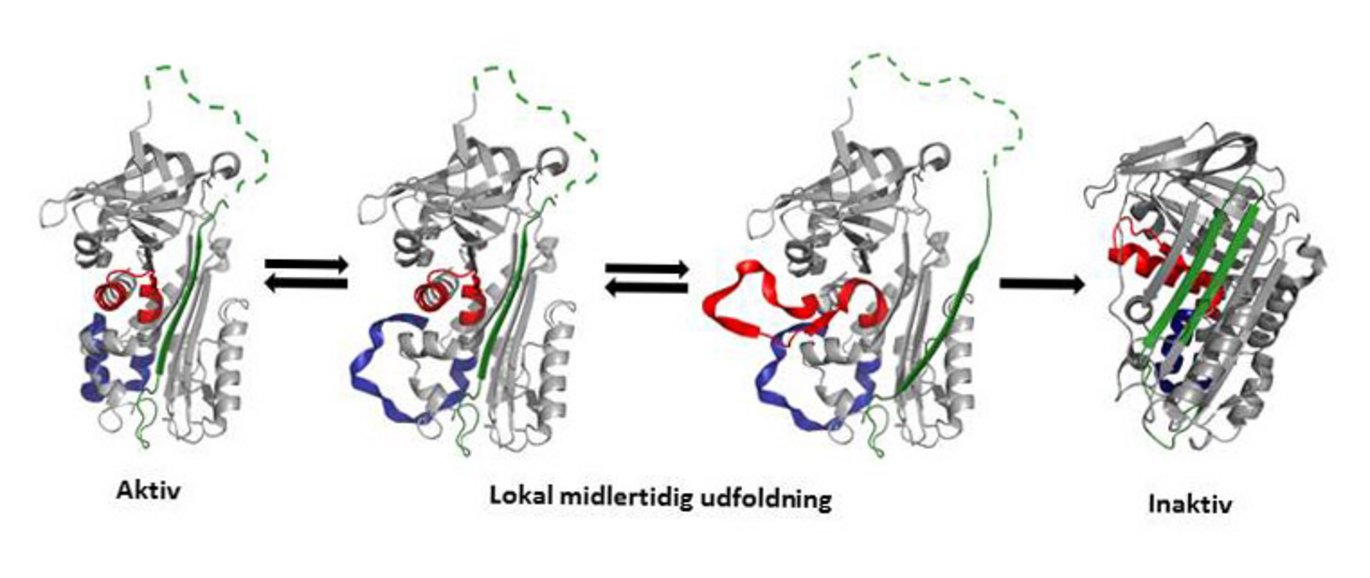
Proteiner regnes normalt for at have en stabil tredimensional struktur med en veldefineret foldning af peptidkæden. Meget tyder imidlertid på, at proteiners peptidkæde konstant undergår småbevægelser, med vidt varierende hastigheder.
For proteinet PAI-1s vedkommende har sådanne bevægelser nu vist sig at være af afgørende betydning for en i molekylet indbygget forældelse, der er tæt sammenknyttet med dets biologiske funktion. I modsætning til de fleste andre proteiners er PAI-1s foldning nemlig ustabil, så PAI-1 spontant, i løbet af et par timer, inaktiveres gennem en af de største kendte omlejringer af et foldet protein. Denne strukturelle omlejring skyldes i virkeligheden en særlig type dynamik i PAI-1s peptidkæde, i form af lokale, midlertidige udfoldninger af flere minutters varighed.
Dette er budskabet i en netop udkommet artikel (”hot paper”) i det højt estimerede kemiske tidsskrift Angewandte Chemie. Opdagelsen er gjort under anvendelse af en særlig teknik, HDX-MS (hydrogen-deuterium exchange monitored by mass spectrometry), som Morten Beck Trelle og Thomas J.D. Jørgensen, Syddansk Universitet, er verdens førende eksperter i. De undersøgelser, der har givet de nye resultater, har kun været mulige med den enestående instrumentering, der er opbygget på Institut for Biokemi og Molekylær Biologi på Syddansk Universitet. Odense-forskerne har samarbejdet med PAI-1-eksperterne Jeppe Buur Madsen og Peter A. Andreasen fra Institut for Molekylær Biologi og Genetik på Aarhus Universitet.
Resultatet er opnået som en del af et vestdansk projekt, ledet af Peter A. Andreasen, der har været støttet af Forskningsrådet for Teknik og Produktion med 14,1 millioner kroner. Projektet har allerede resulteret i flere biokemiske og struktur-biologiske publikationer, men artiklen i Angewandte Chemie repræsenterer det foreløbige videnskabelige højdepunkt.

Forskerne bag de nye resultater i Angewandte Chemie.
Bedre basis for intervention mod risiko for blodpropper
Perspektivet af det gjorte fund er en langt bedre basal forståelse for proteiners indre dynamik. Fundet giver imidlertid også en bedre basis for intervention mod risiko for blodpropper. PAI-1 betyder plasminogen-aktivator inhibitor-1, og PAI-1 er en hurtig og specifik hæmmer af to enzymer, såkaldte plasminogen-aktivatorer, der findes i blod og omkring cellerne i organismen. De to enzymer er mest kendt for at kunne opløse størknet blod, både naturligt, i sår, og sygeligt, i blodpropper. I overensstemmelse hermed er mangel på PAI-1 forbundet med blødningsrisiko. Mest kendt er det imidlertid, at et for højt niveau af PAI-1 i blod, f. eks. i forbindelse med type-2 diabetes, er forbundet med øget risiko for blodpropper. PAI-1s indbyggede forældelse er formodentligt udviklet af evolutionen som en beskyttelse mod risikoen for blodpropper.
Det nye fund giver en langt bedre basis for farmakologisk at justere på, hvor hurtigt forældelsesprocessen sker, hvilket på længere sigt giver bedre basis for at kunne gribe ind mod sygdomme forbundet med øget risiko for blodpropper.
Link til den videnskabelige artikel i Angewandte Chemie: Local transient unfolding of native state PAI-1 is associated with Serpin metastability.
Mere information
Professor Peter A. Andreasen
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
pa@mb.au.dk – mobil: 2899 2589
