Origami på molekylært plan
Professor Daniel Otzen modtager EliteForsk-prisen for sit bidrag til forståelsen og betydningen af proteiners opførsel med særligt henblik på foldning.


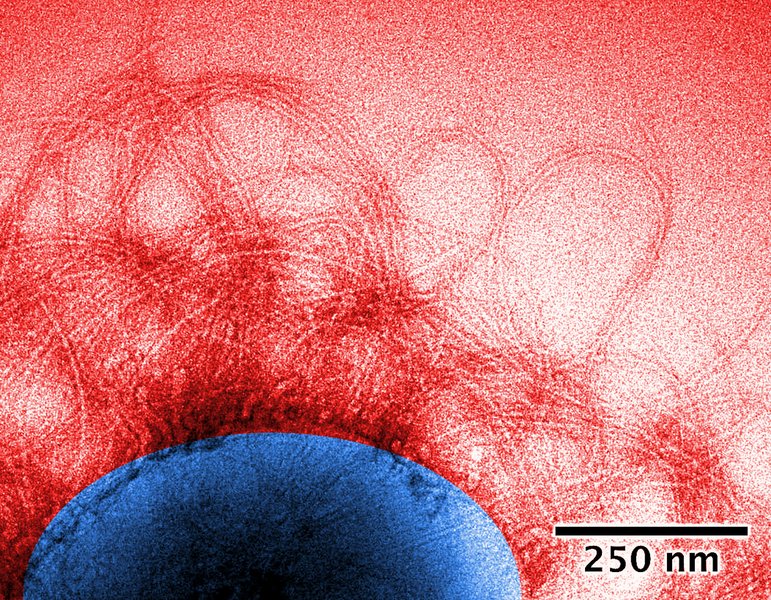
Daniel Otzen fra iNANO og Institut for Molekylærbiologi og Genetik på Aarhus Universitet forsker i proteinmolekyler og arbejder med at forstå, hvordan cellernes ”arbejdsheste”, dvs. proteinerne, er i stand til at gå sammen i større velorganiserede strukturer, som resulterer i både gode og dårlige udfald. Protein-sammenklumpning – også kaldet aggregering – kan give ophav til neurodegenerative sygdomme som Alzheimers og Parkinsons Sygdom – eller medføre blindhed, hvis sammenklumpningen dannes i hornhinden og forhindrer lyset i at komme ind til nethinden, så forskning i disse processer er vitale for at finde behandlingsformer.
Protein-sammenklumpning og -foldning
I den ideelle verden er proteinerne ”designet” til af folde til en veldefineret tre-dimensionel struktur eller fold. Når denne proces fungerer, som den skal, kan proteinerne udføre deres biologiske funktioner.
Foldningen følger nogle simple, men detaljerede regler for kontakten mellem de forskellige aminosyrer i proteinsekvensen eksempelvis ved hjælp af brint-bindinger, salt-broer og hydrofobe (dvs. vandskyende) vekselvirkninger.
- ”Når det går galt med proteinfoldning, kan det skyldes, at proteinerne ”kløjs” i disse folde-regler, dvs. proteinet kan lige så godt lave disse brint-bindinger og hydrofobe vekselvirkninger med andre proteinmolekyler snarere end at holde kontakterne inden for det enkelte proteinmolekyle”, forklarer Daniel Otzen.
-”Grundlæggende kan man se det som en molekylær udgave af immunsystemet, dvs. evnen til at skelne ”selv” (det enkelte molekyle) fra ”ikke-selv” (andre molekyler). Det er en fascinerende udfordring at udrede, fordi selvom proteiner som regel skal folde op på egen hånd, er de værdiløse for cellen, med mindre de er i stand til at kontakte andre proteiner eller andre bio-molekyler (fedtstoffer, kulhydrater, småmolekyler osv.) – så nogen grad af ”ikke-selv” kontakt skal der til. Og denne balancegang (som er endnu mere kompliceret end et moderne parforhold) er da helt fantastisk spændende at forsøge at blive klog på,” fortsætter Daniel Otzen.
- "Proteinsammenklumpningen består af såkaldte fibriller eller amyloider, som typisk er 3-10 nm (0,000000003 – 0,000000010 m) brede men kan være op til flere µm lange. En fibril kan bestå af flere tusinde proteinmolekyler, der er stablet oven på hinanden, hvilket skyldes, at de er gode til at ”kontakte” hinanden, hvorved der dannes meget stabile og regelmæssige brintbindinger mellem de enkelte proteinmolekyler. Så vidt man ved, er alle proteiner i stand til at danne amyloider – under de rette eller forkerte omstændigheder. ”Amyloid-dannelse/fibrillering er med andre ord noget af en urkraft i proteinernes kædedans”, fortæller Daniel Otzen.
- ”Klumpen kan i princippet blive vilkårligt stor, eftersom de enkelte fibriller kan filtre sig mere løst ind i hinanden; det er bare et spørgsmål om, hvor mange proteinmolekyler, der er til rådighed. Hvis fibrillerne dannes uden for cellerne og opbygges af proteiner, der er til fri rådighed, kan det blive temmelig store klumper, der er tale om – bogstaveligt talt kilogram i værste tilfælde, fx i de såkaldte amyloidoser, hvor fibriller kan deponeres i forskellige kropsorganer, fx leveren eller milten, hvor de derved blokerer for organernes naturlige funktion og kan føre til organsvigt,” fortæller Daniel Otzen.
Heldigvis kan der også være gode egenskaber ved fibrillering. Amyloider anvendes til at danne melanosomer, små celle-organeller, der absorberer de farlige UV-stråler og beskytter vores DNA mod lysets skadelige virkninger. Bakterieforsøg har vist, at de fx også kan være med til at opbygge cellevægge samt hjælpe bakterieceller med at binde sig til hinanden eller til andre slags celler, de har således en biologisk funktion – i begge situationer er der tale om en kodet og meget mere kontrolleret proces end i sygdomstilfælde, hvor processen kører af sporet.
Fra forskning til medicin – lidt vej endnu
Daniel Otzen og hans gruppe anvender forskellige metoder til at beskrive, hvordan proteinmolekylerne ser ud i amyloider og i forstadierne, der dannes i fibrilleringsprocessen, dvs. struktur, størrelse og form. Strukturen kan bestemmes vha. spektroskopiske teknikker som cirkulær dikroisme og fluorescens. Størrelsen undersøges vha. lysspredning og kromatografiske metoder, hvor molekyler adskilles efter deres størrelse, og formen defineres via teknikken ”Småvinkel Røntgenspredning”.
- ”Det er lykkedes os at bestemme, hvordan forstadierne til amyloider ser ud på det generelle plan med denne metode; disse forstadier er især interessante, fordi de anses for at være særligt giftige over for cellerne (hvorimod amyloiderne er temmelig sløve biokemisk set og mest ligger og fylder)”, forklarer Daniel Otzen.
Flere andre metoder anvendes i forskningen, og prismodtageren er begejstret for det tværfaglige samarbejde med kolleger på Aarhus Universitet og i Aalborg, Odense, København og på Cambridge Universitet. Moderne forskning kræver ekspertise og mange avancerede teknikker, som sjældent kan klares inden for én forskningsgruppe: ”God forskning kræver evne til godt samarbejde”, siger han.
Næste skridt i forskningsarbejdet er en kobling af gruppens molekylære indsigt med den biologiske virkelighed – hvordan vi får en bedre forståelse for betydningen af de molekylære forvandlinger i cellerne. I praksis betyder det, at man vil forsøge at inddrage flere cellulære aspekter i processen, bl.a. se hvilken betydning tilstedeværelsen af andre cellulære biomolekyler har. Men som Daniel Otzen tilføjer: ”Det er altid et kompromis: jo flere forskellige molekyler og processer, vi studerer samtidig, jo mere virkelighedsnært bliver det, men også mere kompliceret og sværere at fortolke data entydigt. Men vores viden er jo endnu mere værd, hvis vi kan bruge det til at forstå vores omgivelser bedre”!
Daniel Otzen har gennem flere år arbejdet sammen med det forskningsbaserede medicinalfirma Pfizer om udvikling af lægemidler mod Parkinsons Sygdom. Der arbejdes målrettet på at omsætte viden til lægemidler, men det kræver, at man er helt sikker på et eventuelt lægemiddel kan forhindre de uønskede aggregeringsprocesser både i reagensglasset og på celleniveau – men der går nok et par år endnu, vurderer han!
Daniel Otzen har flere ideer til, hvad EliteForsk-prisen på 1 mio. kr. skal bruges til. Han har nogle ”halvvilde” ideer, som han endnu ikke vil løfte sløret for – for som han siger: ”Forskellen på en skør og en genial idé er ofte hårfin – og det skal under alle omstændigheder stå sin prøve i laboratoriet først”. Der ligger mange muligheder i forskningen af amyloider, og prismodtageren kan se det fantastiske i at anvende den viden, vi har om amyloider, til at udvikle og skræddersy forskellige nanoteknologiske løsninger på tidens presserende problemer.
Hædersgaven på 200.000 kr. skal deles med familien og bruges til bl.a. personlige oplevelser og huslig renovering.
 | Se interview med Daniel Otzen om hans forskning. |
 | Se og hør Daniel Otzens foredrag om hans forskning. Daniels foredrag begynder 1 time og 21 minutter inde i optagelsen. |
EliteForsk-prisen blev uddelt første gang i 2007, og siden har repræsentanter fra kongehuset og ministre uddelt fem priser hvert år. Prisen udgør 1,2 mio., hvoraf de 200.000 kr. er en personlig hæderspris, mens de 1 mio. kr. er beregnet på forskningsaktiviteter.
EliteForsk-prisen uddeles til forskere under 45 år, der har internationalt format. Formålet er, som det kan læses på hjemmesiden, ”at finde, styrke og pleje nogle af landets dygtigste og mest talentfulde forskere”. Endvidere hedder det, at ”universiteter, forskningsinstitutioner og private virksomheder med forskningsaktiviteter kan indstille kandidater til prisen. Alle indstillinger vurderes af Det Frie Forskningsråds bestyrelse, der udvælger og indstiller de fem kandidater til uddannelsesministeren.” Læs mere på www.eliteforsk.dk.
Kontakt
Professor Daniel Otzen
iNANO og Institut for Molekylærbiologi og Genetik
Aarhus Universitet
tlf. 2072 5238, mail: dao@inano.au.dk
