Protein pumper kobber, sølv og guld
Forskere fra Aarhus Universitet har som de første i verden kortlagt strukturen af et protein, som pumper kobber-ioner over cellemembranen. Næsten alle organismer er afhængige af dette protein for at kontrollere cellens niveau af kobber, som er essentielt i små mængder, men dødelig giftigt i forhøjede koncentrationer. Resultaterne offentliggøres i denne uge i det førende videnskabelige tidsskrift Nature.
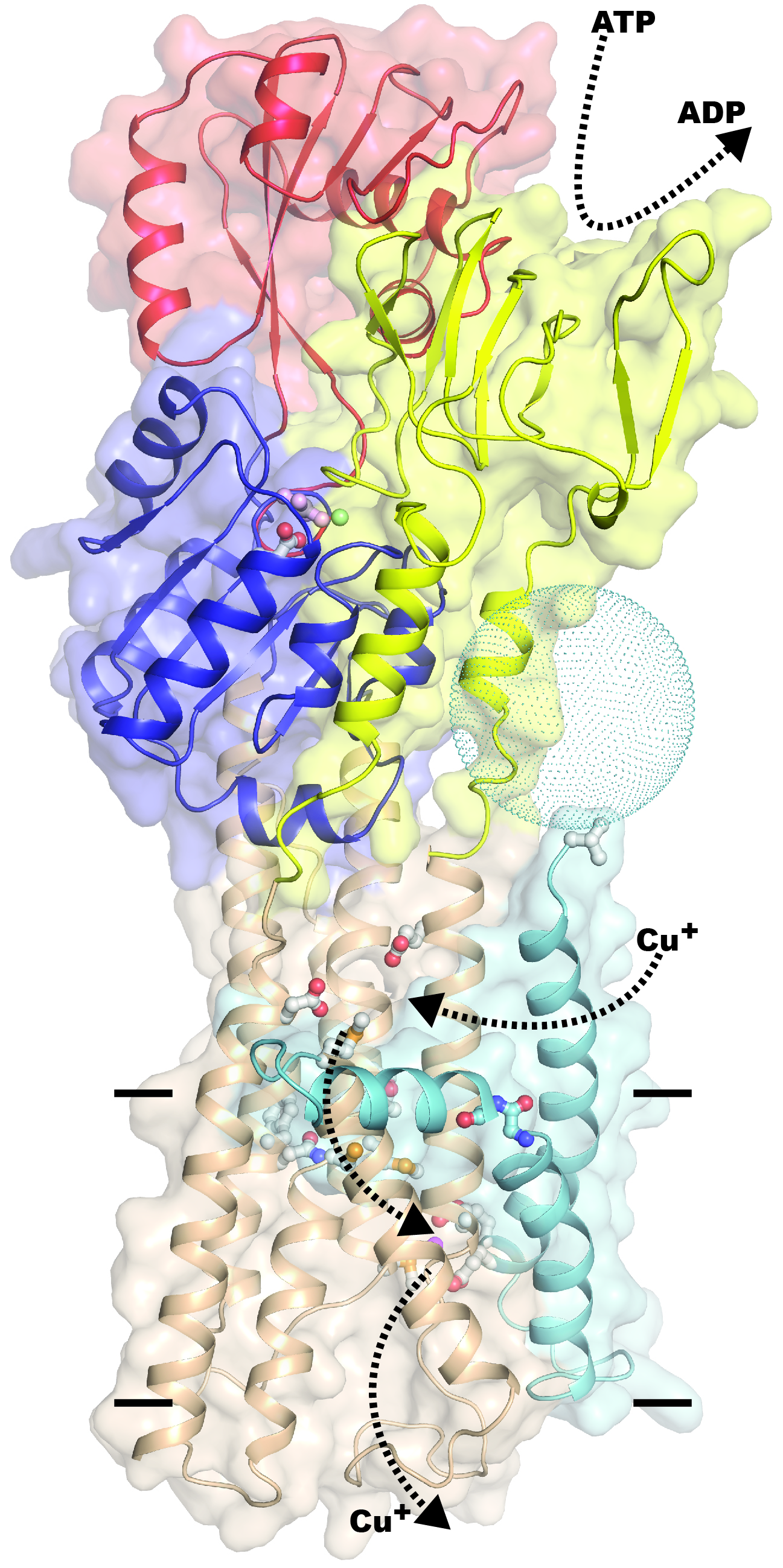
Proteinet er en såkaldt ATP-drevet ionpumpe, kaldet Cu+-ATPase eller CopA. Udover kobber-ioner reagerer CopA også på sølv- og guld-ioner. Proteinets generelle mekanisme er at binde metal-ioner fra den ene side af en cellemembran og ved hjælp af energi frigjort ved ATP spaltning (en såkaldt ATPase aktivitet) at pumpe disse til den anden side. Dette kan også være fra lav til høj koncentration, altså som en opkoncentrering af metalioner.
Proteinet essentielle funktion i cellen og dets unikke egenskaber på interessante metaller giver det mange nye og spændende anvendelsesmuligheder - dels som mål for nye lægemidler mod for eksempel kræft, parasitter og sygdomsfremkaldende bakterier, og dels som nyt bioteknologisk redskab til at udvinde værdifulde metaller såsom kobber, sølv og guld.
CopA proteinet, som forskerne specifikt har undersøgt, er fra bakterien Legionella pneumophila, som giver den dødelige “legionærsyge” (men her klonet ind i en harmløs coli-bakteriestamme). Da Legionella bakterien er afhængig af en funktionel kobberpumpe for at kunne inficere mennesker, er CopA proteinet – der er næsten identiske i alle organismer – et spændende mål for nye antibiotika, som også kan være virksomme mod en lang række andre vanskelige infektioner såsom multiresistente bakterier og tuberkulose.
Et internationalt forskerhold ved Grundforskningcentret Pumpkin på Institut for Molekylær Biologi og Genetik ved Aarhus University stod for forskningsprojektets væsentlige bidrag. Under ledelse af professor og centerleder Poul Nissen bestod holdet af postdoc Pontus Gourdon (svenske forskningsråd), gæstestuderende Xiang-Yu Liu (Peking University) og Carlsbergstipendiat Bjørn P. Pedersen (nu på University of California, San Francisco).
Pumpkin forskerholdet samarbejdede også med genetikere fra Kennedy Centret i Glostrup, ledet af Lisbeth Birk Møller, for at afdække ny viden om genetiske sygdomme relateret til mutationer i menneskets kobberpumper.
Se film med strukturen af ionpumpen:
(efter start, klik på pilene foran Vimeo for stor udgave)
Lang, detaljeret version (2:19 min)
Kort version (1:24 min)
Link til artiklen:
Crystal structure of a copper-transporting PIB-type ATPase
Pontus Gourdon1,2*, Xiang-Yu Liu1,2,3*, Tina Skjørringe4, J. Preben Morth1,2#, Lisbeth Birk Møller4, Bjørn Panyella Pedersen1,2† & Poul Nissen1,2
1Centre for Membrane Pumps in Cells and Disease – PUMPKIN, Danish National Research Foundation.
2 Department of Molecular Biology, Aarhus University, Gustav Wieds Vej 10C, DK-8000 Aarhus C, Denmark.
3State Key Laboratory of Protein and Plant Gene Research, College of Life Sciences, Peking University, Beijing, 100871, P.R. China.
4Center for Applied Human Molecular Genetics, Kennedy Center, Gl. Landevej 7, 2600,Glostrup, Denmark.
† Present address: Department of Biochemistry and Biophysics, University of California at San Francisco, San Francisco, California 94158, USA.
# Present address: The Biotechnology Centre of Oslo and Centre for Molecular Medicine, Nordic EMBL Partnership, University of Oslo, Oslo, Norway.
* These authors contributed equally to this work.
Mere information
Professor Poul Nissen
Institut for Molekylær Biologi og Genetik, Aarhus Universitet
pn@mb.au.dk, 2899 2295 (efter kl. 12 på grund af USA-ophold)
Post-doc Pontus Gourdon
Institut for Molekylær Biologi og Genetik, Aarhus Universitet
pgo@mb.au.dk, 5033 9990
Tekst: Poul Nissen, Pontus Gourdon og Lisbeth Heilesen
