Cirkulært RNA-molekyle ansamler et proteinkompleks og kontrollerer nervecelleudvikling
Under en screening af de såkaldte cirkulære RNA-molekyler har danske forskere identificeret et cirkulært RNA, der overraskende bremser dannelsen af nerveceller. Opdagelserne bidrager til forståelsen af de mekanismer, der styrer nervecellers udvikling med potentiel betydning for neurodegenerative sygdomme.
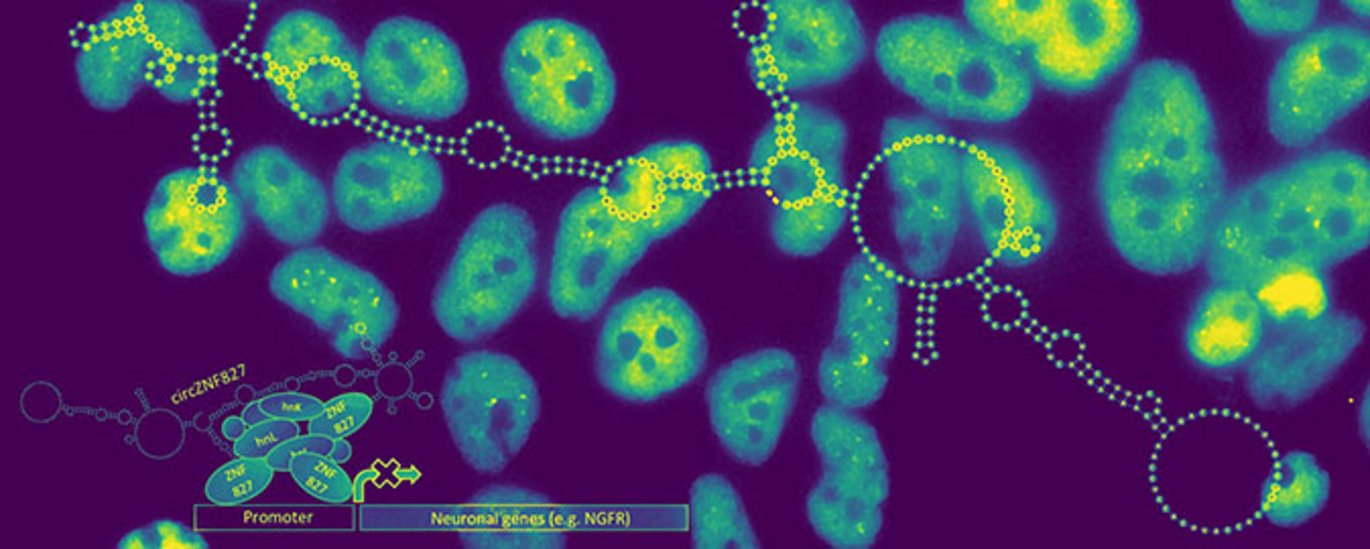
Korrekt timing og kontrol af nervecelledannelse er afgørende for nervesystemets funktion. Når nerveceller udvikles fra stamceller – hvilket kaldes neuronal differentiering – reguleres den hårfine balance mellem stamcellernes evne til hurtigt at kunne vokse og dele sig, og nervecellers evne til at træde ud af cellecyklus og dermed stoppe med at dele sig.
En lang række gener bliver op- eller nedreguleret under denne proces, hvilket leder til dannelsen af både nervespecifikke proteiner og ribonukleinsyrer (RNA’er) - herunder de såkaldte cirkulære RNA’er. Denne store klasse af cirkulære RNA’er, som indtil for nyligt har været fuldstændigt overset, findes i meget høje niveauer i pattedyrs hjerner. Man ved dog stadig ikke om disse specielle molekyler påvirker funktionen af nerveceller eller ultimativt hjernens funktion.
I et studie, udført af postdoc Anne Kruse Hollensen og ledet af lektor Christian Kroun Damgaard fra Institut for Molekylærbiologi og Genetik ved Aarhus Universitet, identificeres tusindvis af cirkulære RNA’er, der induceres, når stamceller udvikler sig til nerveceller. Under en screening af disse molekyler identificerer forfatterne ét cirkulært RNA, kaldet circZNF827, der overraskende bremser nervecelledannelsen ved at skrue ned for en række klassiske nervespecifikke gener.
Biokemiske samt cellebiologiske analyser viser, at circZNF827 mekanistisk virker som en slags fysisk bindingsplatform for en række regulatoriske RNA-bindende proteiner, herunder ZNF827 og hnRNP K/L (se figur). ZNF827 er et relativt ukarakteriseret DNA/RNA-bindende zinc-finger protein, der kommer fra det samme gen, som giver ophav til circZNF827. Dette RNA-protein kompleks ansamles således på en række nervespecifikke geners promotorer, hvor de, når niveauet af circZNF827 er højt, hæmmer transskriptionen af disse gener således differentieringen balanceres korrekt (se figur).
Resultaterne giver altså et interessant eksempel på ”co-evolution” af et gen, der producerer både et proteinprodukt og et circRNA, der regulerer hinandens funktion i en af cellens helt fundamentale processer. Opdagelserne bidrager til forståelsen af de mekanismer, der styrer nervecellers udvikling med implikationer for neurodegenerative sygdomme, og afdækker hvorledes et af hjernens mange circRNA’er spiller en aktiv rolle i dette.
Resultaterne er netop publiceret i det internationale tidsskrift eLife.
Anne Kruse Hollensen, Henriette Sylvain Thomsen, Marta Lloret-Llinares, Andreas Bjerregaard Kamstrup, Jacob Malte Jensen, Majbritt Luckmann, Nanna Birkmose, Johan Palmfeldt, Torben Heick Jensen, Thomas B Hansen, Christian Kroun Damgaard
"circZNF827 nucleates a transcription inhibitory complex to balance neuronal differentiation".
DOI: https://doi.org/10.7554/eLife.58478
Mere information
Lektor Christian Kroun Damgaard
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
ckd@mbg.au.dk - Mobil 29888670
