Ny metode til enkelt-celle analyse kan forbedre kræftbehandling
Et samarbejde mellem danske og amerikanske forskere har resulteret i en udvikling af en ny metode, som tillader måling af enzymaktivitet i enkelte celler fra mennesker. Denne metode vil kunne anvendes til at måle, hvordan celle-til-celle variation i kræftknuder påvirker den samlede respons på kemoterapi og dermed klarlægge nogle af de molekylære årsager til den kemoresistens, der ofte ses hos kræftpatienter. På længere sigt håber forskerne, at metoden vil kunne anvendes til at målrette kemobehandling til de patienter, som har gavn af behandlingen.

Baggrundsinformation
De enzymaktiviteter som måles med metoden tilhører enzymgruppen kaldet DNA topoisomeraser. Medlemmerne af denne enzymfamilie er vigtige i den systemiske behandling af en lang række kræftsygdomme, hvor flere af de almindeligt anvendte kemoterapeutika virker specifikt ved at påvirke topoisomerasers aktivitet. Desværre har det vist sig, at mange patienter enten er resistente over for topoisomerase-rettede kemoterapeutika allerede ved behandlingens start eller udvikler resistens efter den første behandling. Årsagerne til denne resistens er ikke fuldstændig klarlagt, men flere undersøgelser tyder på, at der er en direkte sammenhæng mellem en celles topoisomerase-aktivitetsniveau og den celledræbende effekt af kemoterapeutika.
Kræftceller er typisk karakteriseret ved en høj topoisomerase-aktivitet i forhold til kroppens raske celler, og det er derfor kemoterapeutika af denne type rammer kræftknuder i højere grad end kroppens normale celler. Kræftknuder er imidlertid også karakteriseret ved en meget høj grad af cellediversitet, hvilket vil sige, at de enkelte celler som udgør en kræftknude er meget forskellige. Hvordan denne forskellighed cellerne imellem påvirker den samlede kræftknudes respons på kemoterapi er endnu ukendt, men den forventes at være en af årsagerne til den kemoresistens, der ses hos nogle patienter.
Den udviklede metode gør det for første gang muligt at undersøge forskellighederne med hensyn til topoisomerase-aktivitet mellem enkelte celler i en kræftknude og sammenholde disse til kræftknudens kemorespons, hvilket vil kunne bidrage betydeligt til forståelsen for den molekylære baggrund for kemoresistens.
Beskrivelse af den nye metode
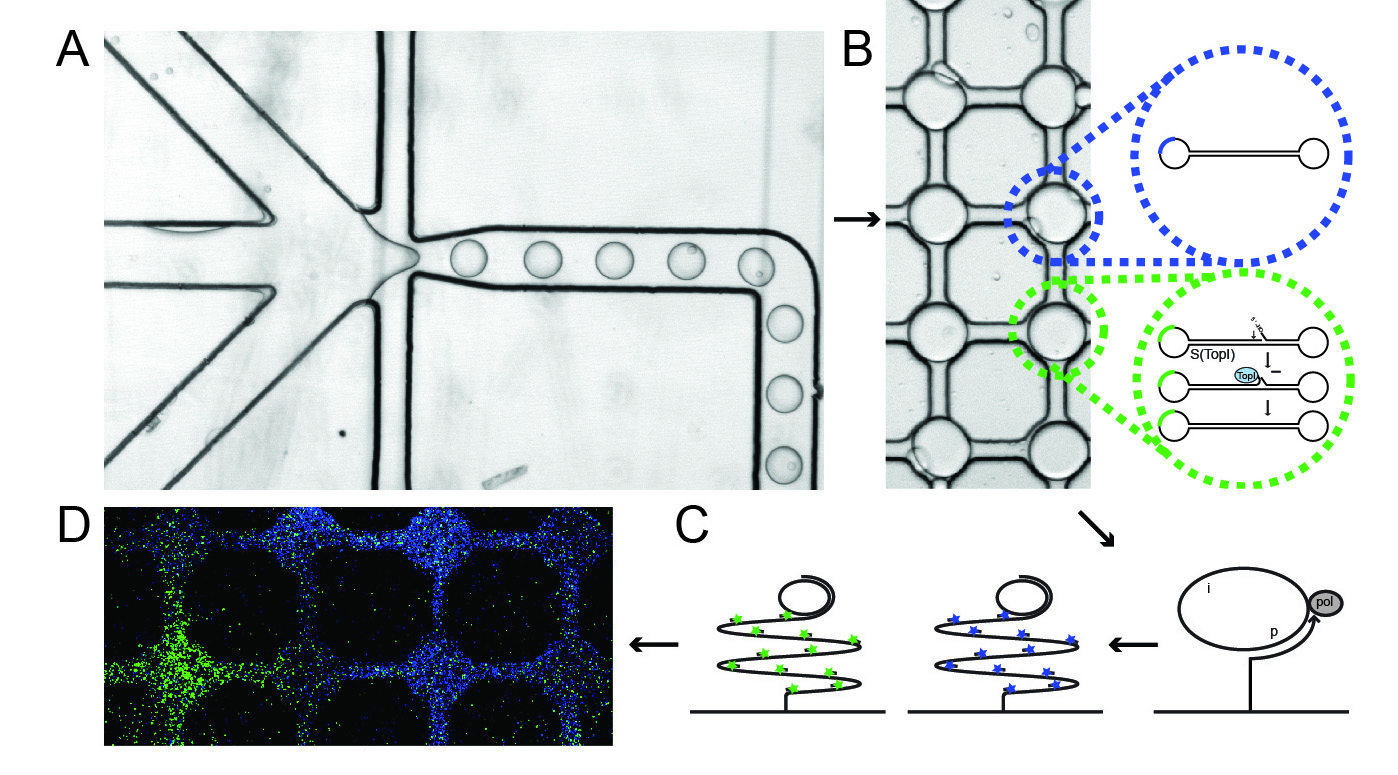
Den nyudviklede metode, der anvendes til at måle topoisomerase-aktivitet i enkelte celler er illustreret i figuren. Metoden er baseret på et såkaldt ”microfluidic” system kombineret med specielle DNA-sensorer, der tillader detektion af hver enkelt katalytisk reaktion medieret af topoisomerasen.
Figurens del A viser, hvordan celler, DNA-sensorer og en specialbuffer – der bryder cellemembranen og tillader de cellulære topoisomeraseenzymer at reagere med DNA-sensorerne – tilføres i hver sin kanal i systemet. Disse komponenter blandes efterfølgende i meget små lipid-indkapslede dråber, hvori topoisomeraserne reagerer med DNA-sensoren.
Figurens del B viser topoisomerasens reaktion med DNA-sensoren, som består af et stykke selvfoldende DNA, der ved reaktion med topoisomerasen omdannes til en lukket DNA-cirkel.
Efter denne reaktion føres blandingen ned på en glasplade, hvor der i forvejen er koblet såkaldte DNA-primere, der understøtter en såkaldt DNA-amplifikationsproces, hvor der fremstilles produkter, som består af 103 kopier af de cirkelrunde DNA-sensorer, som kan synliggøres på enkelt-molekyleniveau via hybridisering til fluoroscerende prober. Denne reaktion er vist i figurens del C. Ud over den beskrevne topoisomerasesensor tilføres systemet desuden en præfremstillet DNA-cirkel, som tjener som kontrol. De cirkelrunde topoisomerasesensorer synliggøres med grønne fluoroscerende prober, mens kontrolcirklerne synliggøres med blå fluoroscerende prober.
Figurens del D viser et eksempel på detektion af topoisomeraseaktivitet (grønne signaler) og kontrolcirkler (blå signaler) i systemet. De enkelte felter viser indholdet af en enkelt lipid-indkapslet dråbe.
Næste skridt
Forskernes nye resultater vil danne grundlag for en lang række målinger af kræftceller, som forhåbentlig vil føre til en større forståelse for de mekanismer, der ligger til grund for kemoresistens. En klarlægning af denne resistens vil på længere sigt hjælpe lægerne til at målrette kemobehandlingen til de patienter, som har gavn af den.
Videoen illustrerer, hvorledes en indkapsling af celler i dråber finder sted, når systemet kører.
Forfatterne bag artiklen kommer fra 1Institut for Molekylærbiologi og Genetik og Interdisciplinært Nanoscience Center (iNANO), Aarhus Universitet, 2Department of Biomedical Engineering, Duke University, Durham, USA og 3Patologisk Institut, Aarhus Universitetshospital
Sissel Juul1, Yi-Ping Ho2, Jorn Koch3, Félicie F. Andersen1, Magnus Stougaard3, Kam W. Leong2 og Birgitta R. Knudsen1
Link til artiklen:
Detection of Single Enzymatic Events in Rare- or Single Cells Using Microfluidics, der netop er publiceret i det internationale tidsskrift ACS Nano.
Mere information
 | Lektor Birgitta R. Knudsen |
Tekst: Sissel Juul og Lisbeth Heilesen
