Slut med ’Pump Fiction’
Vores celler er i stand til at flytte energi og stof rundt til de steder, der er behov for den og sikre, at kroppen fungerer. Men hvordan gør cellerne det i realtid og i det enkelte molekyles perspektiv? Det er lykkedes et dansk forskningshold at afdække nogle basale indsigter i denne hidtil ukendte verden ved at udføre de første forsøg, der viser, hvordan et enkelt molekyle af den molekylære ’motor’, kendt som calcium-pumpen, fungerer. Opdagelsen er netop offentliggjort i det førende tidsskrift <em>Nature</em>.

For første gang er det blevet muligt at se ind i kroppens helt fundamentale motorrum, og observere på de ionpumper, der aktiverer cellens transport og signalsystemer. En funktion, der sikrer at din, min og alle andre biologiske væsner her på Jorden fungerer, som de skal med de rette biomolekylære mekanismer.
Den såkaldte calcium-pumpe syner ellers ikke af meget. Hver pumpe er nogle få nanometer - milliontedele millimeter - på hver led, og sidder i cellemembranerne i vores krop. Men den er nu vigtig nok. Pumpen er bl.a. grunden til, at vores muskler kan trække sig sammen og at nerveceller kan sende signaler. Hvis den lille pumpe holdt op med at virke, ville cellerne stoppe med at kommunikere - uden dem bevægede vi os ikke og havde ingen tanker. Det bruger cellerne derfor rigtig meget energi til – omkring en fjerdedel af kroppens brændstof, det såkaldte ATP, bliver brugt til at holde pumperne kørende.
Der er endnu mange ting, vi ikke ved om den livsvigtige pumpes funktion og struktur. Viden om pumpen er derfor afgørende for, at vi kan forstå energiregnskabet og vigtige funktioner i kroppen.
En dansk forskningsgruppe har netop udsendt et nyt studie, der for første gang nogensinde viser, hvordan pumpen fungerer på niveau af det enkelte molekyle, og har påvist hvordan den formår at sikre, at den pumper ioner i den rigtige retning: kort forklaret, hvordan den fungerer som en slags ’ensretter’ i molekylestørrelse inde i vores krop. Opdagelsen er offentliggjort i det højt ansete tidsskrift Nature.
”Arbejdet her repræsenterer det næste skridt i en dyb og vigtig erkendelse på vejen mod forståelsen af pumpens atomare struktur og funktion. Vi er nu kommet nærmere en forståelse af, hvordan ionpumpen sikrer cellernes funktionalitet, og vi har i hidtil uset detaljegrad klarlagt, hvordan ioner egentlig transporteres ud af cellen. Den grundviden om biofysiske processer er utroligt værdifuld, og vil have stor betydning for indsigten i livsprocesser og – på sigt – bl.a. sygdomsbekæmpelse,” siger professor Poul Nissen, der både leder grundforskningscenteret PUMPkin og neuroforskningscenteret DANDRITE, og som er blandt verdens førende forskere på området og medforfatter på artiklen.
Den molekylære stopklods
Arbejdet fører på sin vis tilbage til 1950’erne, da professor Jens Christian Skou udførte pionerarbejdet på Aarhus Universitet med at afdække, at der fandtes sådanne pumpefunktion i vores celler. Calcium-pumpen er en fætter til den natrium-kaliumpumpe, Skou arbejdede med, og de benytter sig af tæt beslægtede mekanismer. Arbejdet indbragte ham Nobelprisen i kemi i 1997. Siden hans første opdagelser har talrige forskere forsket i pumpernes funktionalitet og mekanisme – herunder på grundforskningscentret PUMPkin, Center for Membranpumper i Celler og Sygdom, på Aarhus Universitet.
Kernen i det hidtil ukendte element af pumpemekanikken afløser en tidligere formodning om, at ensretningen af pumpens funktion opstår i spaltningen af det energirige molekyle ATP. Tanken var, at når ATP var spaltet, ville pumpen ikke gå tilbage og dermed gendanne ATP. Det viste sig langt fra at holde stik:
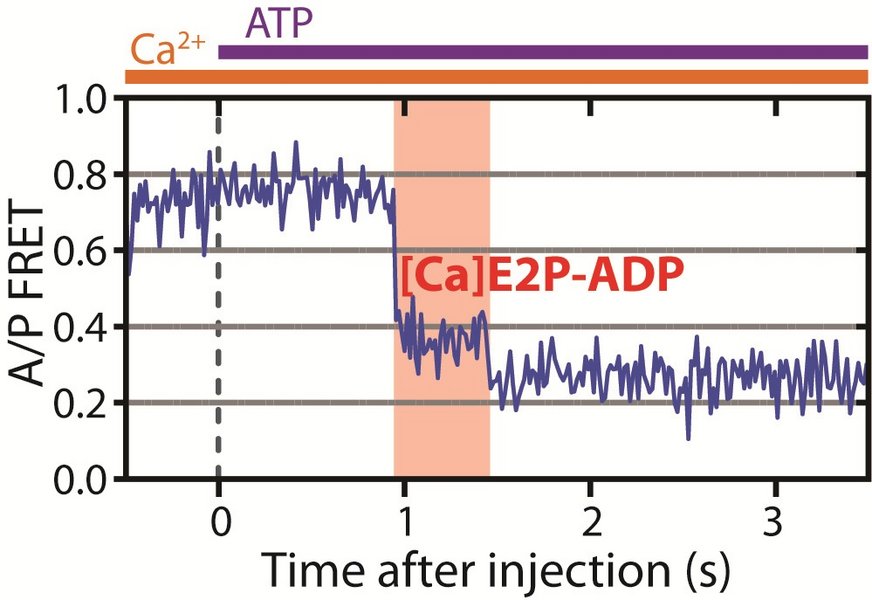
”Vi har fundet frem til en ny tillukket tilstand i pumpecyklussen, og som pumpen kun kan komme til, hvis calciumionen er kommer fra cellevæsken og pumpen har spaltet ATP, men ikke hvis ionen kommer fra cellens omgivende miljø. Når calcium slippes fri fra denne tilstand er det ”point of no return”. Det er den mekanisme der gør, at pumpen overhovedet kan fungere som en pumpe og ikke som en passiv tragt.
Det er ganske unik viden, som har skabt på basis af meget avancerede forsøg, der gør det muligt at se pumpen udføre sin opgave i realtid for første gang nogensinde,” forklarer postdoc Mateusz Dyla, der er førsteforfatter på den netop udgivne artikel, og som har været hoveddrivkraften på projektet lige siden det indledtes som hans ph.d. forskningsprojekt.
Calcium-pumpen skal bruge energi og det får den som sagt ved hjælp af et ATP-molekyle, der spaltes og afgiver energi, der kan omsættes til pumpens arbejde. Det er derfor, der bliver opbygget store koncentrationsforskelle mellem cellens indre og ydre miljø. Der kan være mere end 10.000 ganges koncentrationsforskel, og disse meget kraftfulde forskelle er essentielle for kommunikation i og mellem celler såsom ved udsendelse af nerveimpulser.
Røg og spejle
Baggrunden for arbejdets store kompleksitet er ret basal: pumpen er meget lille, og kan ikke observeres direkte i et lysmikroskop. Hidtil har man ved møjsommelige studier kunnet afbilde pumpen i forskellige stabile tilstande ved hjælp af såkaldt røntgenkrystallografi, hvilket kan sammenlignes med ”stop motion” filmoptagelse. Forskerne har derfor også spøgefuldt betegnet det som ’pump fiction’ at visualisere ionpumpens cyklus. De nye opdagelser har taget fem år at udføre, og flytter visualiseringsteknikken fra ’stop-motion’ til direkte målinger af pumpens funktionelle bevægelser. Den forhøjede opløsning og autentiske animationen er også det, der gør det muligt at se den helt nye tilstand.
Teknikken kaldes enkelt-molekyle fluorescens-spektroskopi og anvender såkaldt Förster Resonance Energy Transfer, kort betegnet FRET. Her kombinerer man laserlys og ultra-følsomme kameraer for, som noget nyt, at kunne fokusere på et enkelt molekyle og helt konkret se, hvad det foretager sig i realtid ved at måle bittesmå forskelle i fluorescenslyset fra molekylerne
Gruppen har taget udgangspunkt i Listeria-bakteriens calciumpumpe, som de har formået at håndtere i de meget avancerede studier ved såkaldt protein engineering.
I forsøget bliver to farvestofmolekyler påsat pumpemolekylet, som belyses med laserlys. Det ene farvestof kaldes ’donoren’. Donoren vil optage lyset som energi og udsende lys af en bestemt farve (fluorescens), som så rammer det andet farvestof, der derfor udsender lys af en anden farve. Lyset vil derfor både blive udsendt fra donoren og acceptoren med forskellige farver. Ved at måle, hvor meget lys der udsendes af de to farver, kan forskerne få information om, hvor lang afstand, der er mellem donor og acceptor-molekylet. Da de er påsat på to specifikke positioner i pumpen, siger det derfor noget om, hvordan pumpen bevæger sig.
Teknikken har gjort det muligt at følge pumpens funktion med hidtil ukendt grad af detalje, forklarer fellow Magnus Kjærgaard fra Aarhus Institute of Advanced Studies, AIAS, der også har bidraget til opdagelserne:
”Vi er gået fra Pump Fiction til Pump Live. Hvor man tidligere fik signaler tilbage fra virkelig mange molekyler, og dermed ikke kunne dechifrere de finere detaljer i deres funktioner, kan vi nu med enkelt-molekyle FRET fokusere på ét molekyle og se det arbejde. Det giver os en video af pumpen in action med langt færre ’huller i filmstrimlen”. Vores Pump Fiction-film fik sit øgenavn i sin tid, da vi vidste overgangen imellem de forskelle tilstande var rent gætværk, og at der kunne være huller i animationen, som kunne gemme på indsigt. Det har vi nu vist til overmål og samtidig opnået central indsigt om, hvordan pumpen fungerer.”
Udover at tilføje central viden til livsprocessernes basale mekanismer fremmer den dybere forståelse af pumpernes strukturelle og mekanistiske principper også anvendt forskning. Hvis pumper for eksempel er muterede og derfor en smule defekte i hjerneceller kan det forårsage neurologiske lidelser som migræne eller anfald af halvsidige lammelser og neurodegenerative lidelser.
Viden om ionpumperne er derfor centrale for, at vi kan forstå de sygdomsmekanismer, der er forbundet med fejl i pumpen; ikke mindst for at kunne udvikle nye lægemidler rettet mod pumpen på sigt.
”Vi er stadig ikke i mål med at overføre forskningen i ionpumper til nye sygdomsbehandlinger, men vi har fået nye indsigter og dermed også fået nye ideer til at udvikle nye metoder til kortlægning og behandling af defekter i f.eks. nervesignalering. Men det er fremtidigt arbejde, der vil afdække de muligheder. Nu er der grund til at glædes over, at det er muligt at afdække ”intime detaljer” af et af livets vel nok mest vigtige enzymer. Det har taget afsæt i gode samarbejder her på universitetet og med forskere i USA og giver fremragende muligheder for nye samarbejder,” siger professor Poul Nissen.
Artiklen ‘Dynamics of P-type ATPase transport revealed by single-molecule FRET’ er offentliggjort d. 8. November 2017, og kan findes på Natures hjemmeside via dette link.
Verdenspremiere:
Se her en kort videoillustration af pumpens cyklus, der viser hvordan den sender calciumioner ud af cellen. De blå prikker på filmen repræsenterer calcium. Animationen er lavet af forskerne og kan findes via dette link.
Mere information
Professor Poul Nissen
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
2899 2295 - pn@mbg.au.dk
Postdoc Mateusz Dyla
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
mateusz@mbg.au.dk
Fellow Magnus Kjærgaard
Aarhus Institute of Advanced Studies, Institut for Molekylærbiologi og Genetik, Aarhus Universitet
8715 3773 - magnus@aias.au.dk
