Afsløring af mekanisme bag fundamentale stress-regulerede cellulære processer
Danske og canadiske forskere har sammen afdækket vigtige molekylære detaljer omkring reguleringen af cellens biosyntese-maskineri under cellulært stress. Den nye viden kan have betydning for cancerbehandling, da de implicerede faktorer blandt andet kontrollerer cellens vækst og evne til at dele sig.
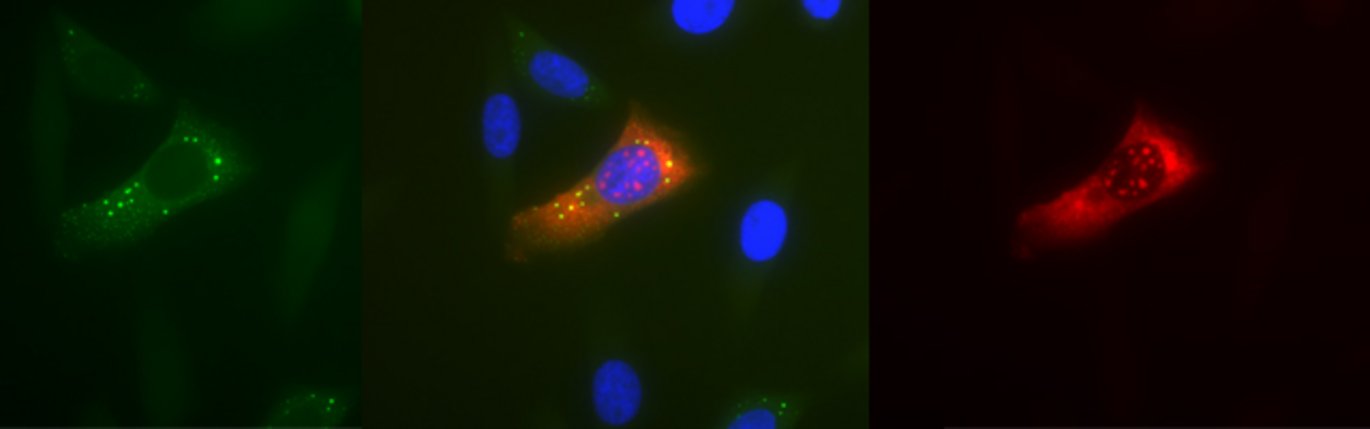
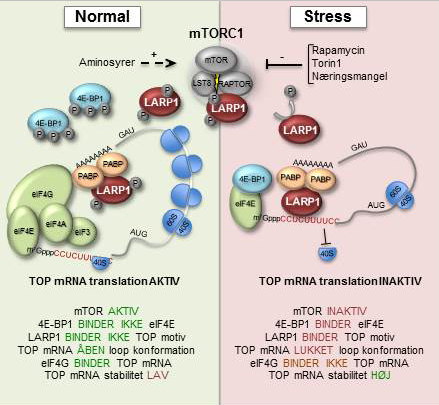
Når celler udsættes for stress, såsom næringsmangel, iltmangel eller forhøjet temperatur, omprogrammeres deres genekspression inden for minutter, hvilket overvejende sker ved regulering af cellens biosyntese-maskineri, som blandt andet består af såkaldte ribosomer. Ribosomer er makromolekylære ’maskiner’, der aflæser den genetiske kode ved at oversætte, eller ’translatere’, cellens ’messenger RNA’ (mRNA) til proteinstof. Under stress bliver en stor klasse af mRNA, der indeholder et unikt sekvenselement (TOP mRNA), specifikt ekskluderet fra ribosomerne (se figur), hvilket gør cellerne i stand til at overleve og håndtere de ellers hårde betingelser. Denne delikate proces er kontrolleret af en række cellulære signaler, herunder signalvejen hvor mTOR (mammalian Target Of Rapamycin) er helt central.
Studiet har afdækket hvorledes aktiviteten af mTOR overføres helt ned til ribosomerne, ved at identificere et hidtil ukendt substrat for mTOR fosforylering, LARP1, der viser sig specifikt at hæmme TOP mRNA translation under stressbetingelser (se figur).
mTOR og LARP1 skruer ned for cellens translation og energiforbrug under stress
Under normale vækstbetingelser fosforyleres LARP1 af den aktive mTOR kinase, hvilket regulerer proteinets evne til at binde TOP mRNA (se venstre side af figur). Når mTOR inaktiveres ved cellulært stress eller ved at tilføre celler specifikke mTOR inhibitorer, vil LARP1 ikke længere blive fosforyleret. Dette medfører øget LARP1-binding til TOP mRNA og translationen hæmmes effektivt (se højre side af figur).
Studierne har ligeledes afdækket, hvorledes dette sker rent mekanistisk. Det viser sig nemlig at LARP1 konkurrerer om binding til TOP mRNA med en translationsfaktor, eIF4G, som normalt stimulerer ribosomernes binding til mRNA inden translationsprocessen starter. Når mTOR inaktiveres (under stress) ’vinder’ LARP1 over eIF4G og vil sørge for at cellen indenfor minutter lukker ned for translation af hundredvis af TOP mRNA. Dette sparer på cellens ressourcer og giver den tid og energi til at starte et stress-beredskab, der sikrer videre overlevelse.
En række mTOR-inhibitorer bliver i øjeblikket brugt i kliniske forsøg mod forskellige cancerformer, idet mTOR stimulerer cellevækst og celledeling, som vides at være ukontrolleret i cancer. Givet at mTOR aktivitet og dermed cellers vækstpotentiale kan hæmmes med disse specifikke inhibitorer, kan LARP1 vise sig at være en vigtig markør for udviklingen af resistens mod anti-cancer medicin.
Den videnskabelige artikel er for nyligt publiceret i det amerikanske tidsskrift Journal of Biological Chemistry: http://www.jbc.org/content/early/2015/05/04/jbc.M114.621730.long
Mere information
Lektor Christian Kroun Damgaard
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
ckd@mbg.au.dk - 2970 0599
