Kalciumpumpe taget på fersk gerning
Forskere ved Aarhus Universitet har beskrevet et af cellens centrale enzymer, kalciumpumpen, i et afgørende øjeblik - en såkaldt overgangstilstand - hvor en katalyseret aktivitet gør vendepunktet fra bundet substrat til produkt. Disse resultater giver et meget detaljeret billede af, hvordan en af de mest energiforbrugende processer i kroppen finder sted. Kalciumpumper er tæt knyttet til muskelaktivitet såsom hjertemuskulaturen. De regnes derfor for at være yderst lovende mål for udvikling af nye typer medicin til fx hjertelidelser.
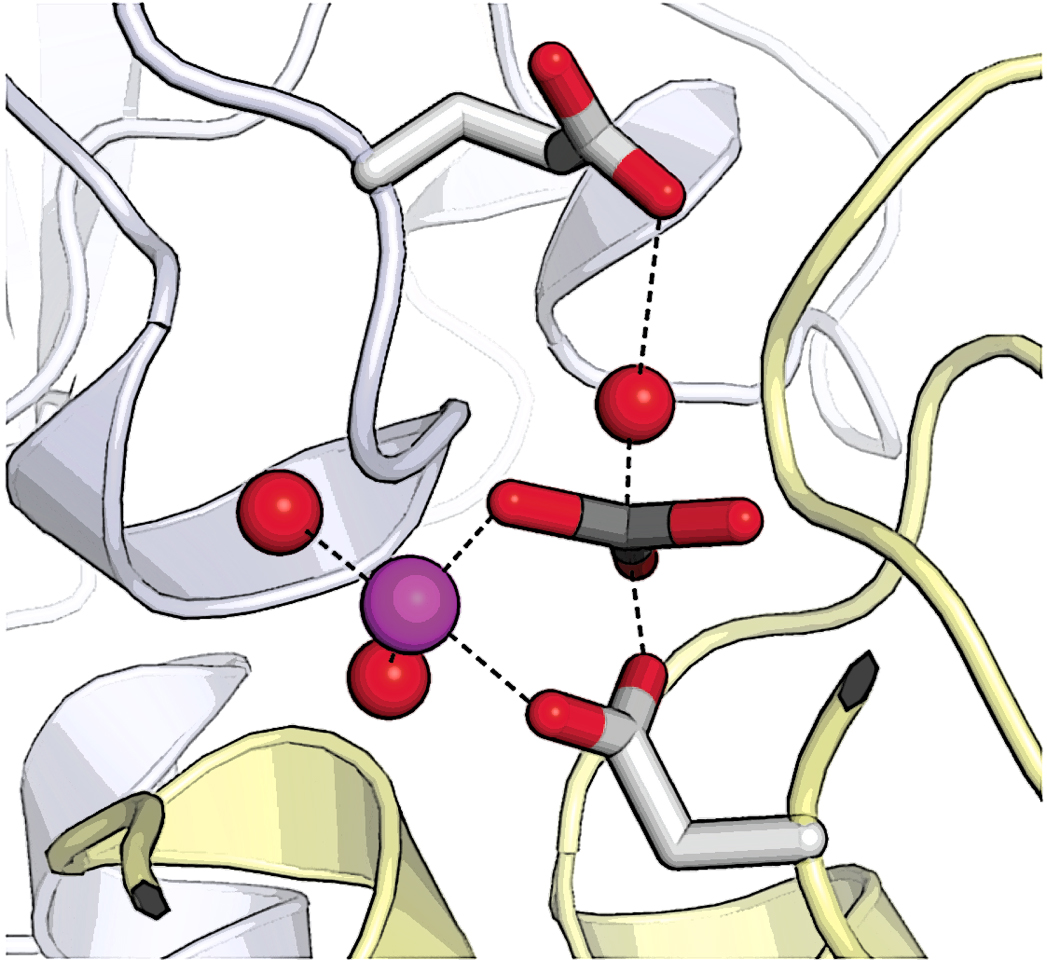
Enzymet er den kalcium-pumpende Ca2+-ATPase kaldet SERCA - et ionpumpe-protein, der opretholder en kalciumkoncentration i cellen, der er omkring 20.000 gange lavere indenfor end udenfor. Dog pumper dette protein ikke kalcium-ionerne ud af cellen, men derimod ind i et lagerrum i cellen kaldet sarco-endoplasmatisk reticulum.
En sådan pumpeaktivitet kræver energi – masser af energi – som kommer fra en totrins-spaltning af det energi-rige molekyle kaldet ATP. Faktisk bruger Ca2+-ATPase og relaterede ATP-drevne ionpumper såsom natrium-kalium-pumpen (Na+, K+-ATPase) omkring en tredjedel af den ATP, der forbruges i kroppen og op til 75% i hjernen, da disse store ionkoncentrationsgradienter driver mange andre processer i cellen, svarende til den elektriske strøm fra et batteri.
Da ionpumperne er så vigtige, er en nedsat aktivitet af disse – fx ved mutationer eller toksiske forbindelser der hæmmer dem – forbundet med sygdomme. Men omvendt kan ionpumper tilgås med medicinske lægemidler til at lindre ubalancer i ionkoncentrationer forbundet med sygdom, eller ved at blokere ionpumper i kræftceller eller patogene bakterier eller parasitter. Der er derfor stor interesse i at vide, hvordan de fungerer på atomart plan, så man kan udvikle gode strategier i denne lægemiddeludvikling.
For at få en sådan indsigt brugte forskerholdet røntgenkrystallografi efter at have krystalliseret kalciumpumpen i en tilstand, der efterligner det sidste trin af den ATP-kløvende reaktion. I dette trin spaltes et fosfoenzym mellemprodukt, så fri fosfat frigøres som det endelige produkt af ATPase reaktionen. Dette indtræder efter kalcium er blevet frigivet i sarco-endoplasmatiske reticulum lageret, og genstarter pumpen til en ny cyklus.
Dette trin efterlignes nøje af den kemiske forbindelse vanadat, hvor fosforatomet erstattes af grundstoffet vanadium og derfor frembringer et stabilt kompleks i stedet for en overgangstilstand. Derved fremkommer et meget nøjagtigt billede af, hvordan enzymet stabiliserer overgangstilstanden og katalyserer det sidste trin i ATP-spaltningsreaktionen. Dette har med andre ord fanget et øjebliksbillede af, hvordan en meget markant mængde af kroppens energiforbrug finder sted.
Denne indsigt er af central betydning for vores indsigt i livsprocessernes grundlæggende mekanismer. Kalciumpumper er tæt knyttet til muskelaktivitet såsom hjertemuskulaturen. De regnes derfor for at være yderst lovende mål for udvikling af nye typer medicin til fx hjertelidelser. Kalciumpumper er også centrale for kroppens samlede stofskifte og energiforbrug, som er tæt forbundet med sundhed.
Artiklens to første-forfattere arbejder i dag med henholdsvis lægemiddeludvikling i det danske biotek-firma Pcovery (Johannes Clausen) og som nystartet lektor ved Oxford Universitet (Maike Bublitz).
Undersøgelsen er offentliggjort i det internationale tidsskrift Structure:
http://www.cell.com/structure/pdf/S0969-2126(16)00077-0.pdf
Mere information
Professor Poul Nissen
Institut for Molekylærbiologi og Genetik/DANDRITE
Aarhus Universitet
pn@mbg.au.dk – 2899 2295
Dr. Johannes Clausen
Pcovery Aps, Ole Maaløes Vej 3
2200 København N
jc@pcovery.com - 5159 4560
Dr. Maike Bublitz
Associate Professor of Microbial Biophysics
Department of Biochemistry, University of Oxford
maike.bublitz@bioch.ox.ac.uk +44 1865 613221
