Molekylære kontakter er ikke bare ”tændte” eller ”slukkede”
Det er ikke altid nemt at se, om en kontakt er tændt eller slukket! Et nyt studium viser, at det samme kan gøre sig gældende for en molekylær kontakt. Denne viden giver et nyt syn på de molekylære kontakter, GTPaserne, hvoraf mange er mulige medicinske mål.
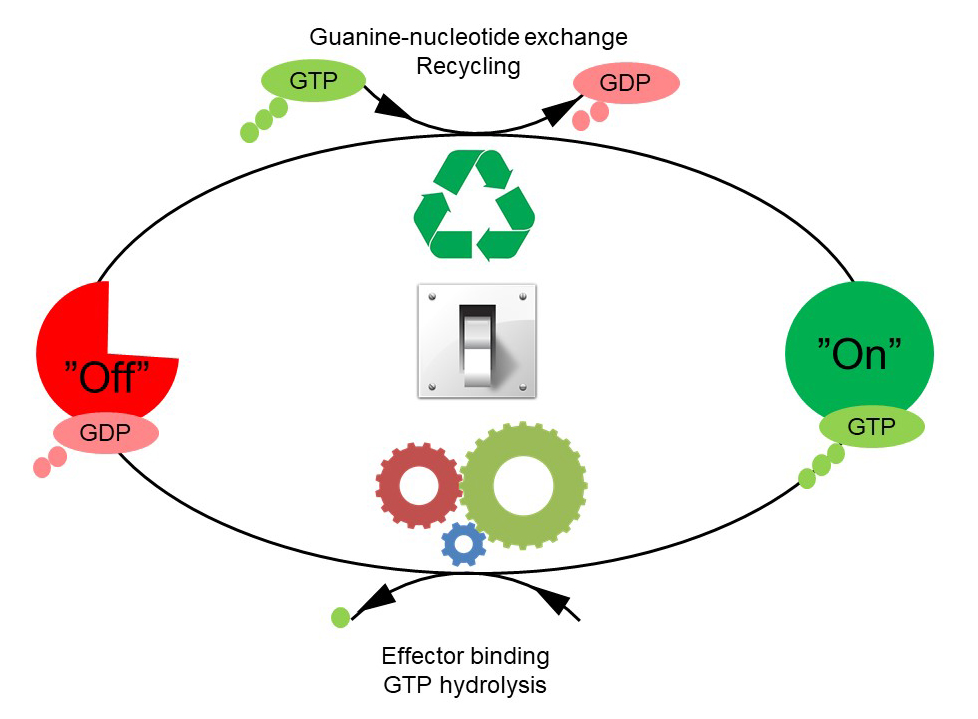
GTPaserne er en meget stor protein-familie, hvis medlemmer er involveret i kontrol af cellevækst, transport af molekyler, syntese af andre proteiner m.m. På trods af GTPasernes mangeartede funktioner fungerer de efter et fælles cyklisk mønster (Figur 1). GTPasernes aktivitet reguleres af faktorer, som kontrollerer GTPasernes evne til at binde og hydrolysere guanosin-trifosfat (GTP) til guanosin-difosfat (GDP). Den generelle opfattelse har hidtil været, at en GTPase er aktiv eller ”tændt”, når den er bundet til GTP, og er inaktiv eller ”slukket”, når den er bundet til GDP. GTPaserne betegnes derfor af og til som molekylære ”kontakter”.
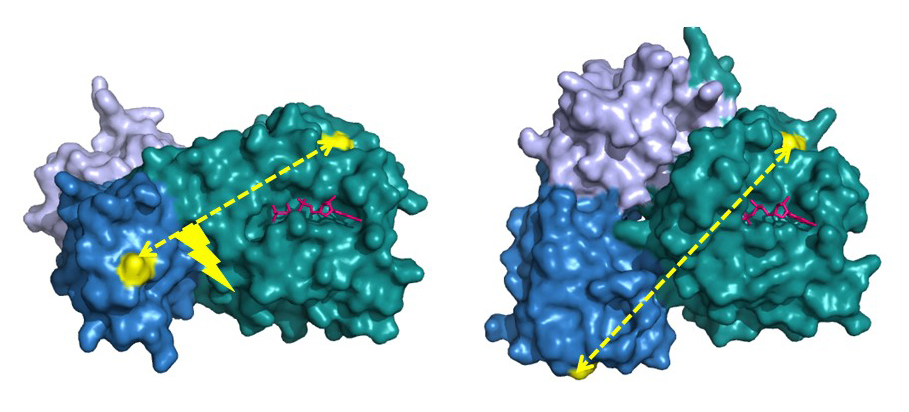
Den bakterielle translationselongeringsfaktor EF-Tu er en GTPase, som spiller en afgørende rolle under syntesen af proteiner i bakterier, idet faktoren transporterer de aminosyrer, som opbygger en celles proteiner, til den cellulære proteinsyntesefabrik, ribosomet. Hidtidige strukturstudier ved brug af røntgenkrystallografi har vist, at EF-Tu optræder i to vidt forskellige tre-dimensionelle former alt efter om faktoren er ”tændt” (dvs. bundet til GTP) eller ”slukket” (dvs. bundet til GDP) (Figur 2). Man har derfor troet, at det var bindingen af GTP/GDP, som var afgørende for faktorens struktur konformation.
Et forskningssamarbejde imellem forskere fra Institut for Molekylærbiologi og Genetik ved Aarhus Universitet og to amerikanske universiteter afslører imidlertid, at EF-Tu’s – og sandsynligvis også andre GTPasers – struktur og funktion er langt mere kompleks end hidtil antaget. I Søren Thirups gruppe har man udført røntgenkrystallografisk analyse af EF-Tu fra E. coli og vist, at EF-Tu bundet til en variant af GTP, GDPNP, også kan optræde i den ”slukkede” form, som er karakteriseret ved en mere åben struktur. I et samarbejde med amerikanske forskere foretog Charlotte Knudsens ph.d.-studerende, Darius Kavaliauskas, yderligere studier ved brug af en særlig form for fluorescens mikroskopi, som gør det muligt at observere den rumlig opbygning af EF-Tu-molekyler enkeltvis i opløsning.
EF-Tu blev mærket med en fluorescens-donor og en fluorescens-acceptor. Når donoren bestråles med lys af en bestemt bølgelængde, vil lyset absorberes og udsendes som lys med en ny bølgelængde. Acceptoren vil opfange lyset og genudsende det ved en tredje bølgelængde, hvis den er placeret tæt på donoren. Det udsendte lys måles i et konfokal-mikroskop, hvorved afstanden imellem donor og acceptor i EF-Tu-molekylerne kan bestemmes for tusindvis af molekyler i opløsning, således at man får information om bevægeligheden af EF-Tu.
GTPaserne er langt mere dynamiske end antaget
Studiet viste, at EF-Tu i opløsning ikke befinder sig i en fastlåst struktur, når faktoren var bundet til GDP eller variationer med GDPNP, og således burde være henholdsvis ”slukket” eller ”tændt”. I stedet viste EF-Tu sig at være særdeles dynamisk ved at optræde som en blanding af strukturer. Denne tendens var mest udpræget, når GDPNP indgik i opløsningen i overensstemmelse med det røntgenkrystallografiske studie. Først ved binding til ribosomet indtog EF-Tu den forventede, aktive form (Figur 2, venstre).
Resultaterne indikerer, at man fremover skal anskue GTPaserne som langt mere fleksible molekyler, der ikke bare er ”tændte” eller ”slukkede”. GTPaser er oplagte mål i forbindelse med udvikling af medicin: f.eks. kan bakterieinfektioner principielt bekæmpes ved hæmning af EF-Tu, mens GTPasen ras p21 er misreguleret i ca. 30 % af alle kræftformer – især de særligt dødelige former i lunger, tyktarm og bugspytkirtlen. Indtil videre er det imidlertid ikke lykkedes at udvikle brugbar medicin mod disse to mål, men opdagelsen af GTPasernes store fleksibilitet kan måske være med til at ændre på dette.
Den videnskabelige artikel er netop publiceret i det internationale tidsskrift Nucleic Acids Research:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gky697/5070485
”E. coli elongation factor Tu bound to a GTP analogue displays an open conformation equivalent to the GDP-bound form”.
Jesper S. Johansen, Darius Kavaliauskas, Shawn H. Pfeil, Mickaël Blaise, Barry S. Cooperman, Yale E. Goldman, Søren S. Thirup, and Charlotte R. Knudsen.
Mere information:
Lektor Søren Skou Thirup - 2058 5981 - sth@mbg.au.dk
Lektor Charlotte Rohde Knudsen – 2057 2372 - crk@mbg.au.dk
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
