Strukturen af en utro følgesvend
Danske forskere har bestemt den tredimensionelle struktur af enzymet kaldet PAPP-A. Resultaterne åbner mulighed for at forstå den grundlæggende biologi, der regulerer højdevækst af hvirveldyr – og i den sidste ende også mennesker. De samme mekanismer er også involveret i mange aldersrelaterede sygdomme, og derfor er forskningen et vigtigt skridt i retning af udviklingen af nye lægemidler.
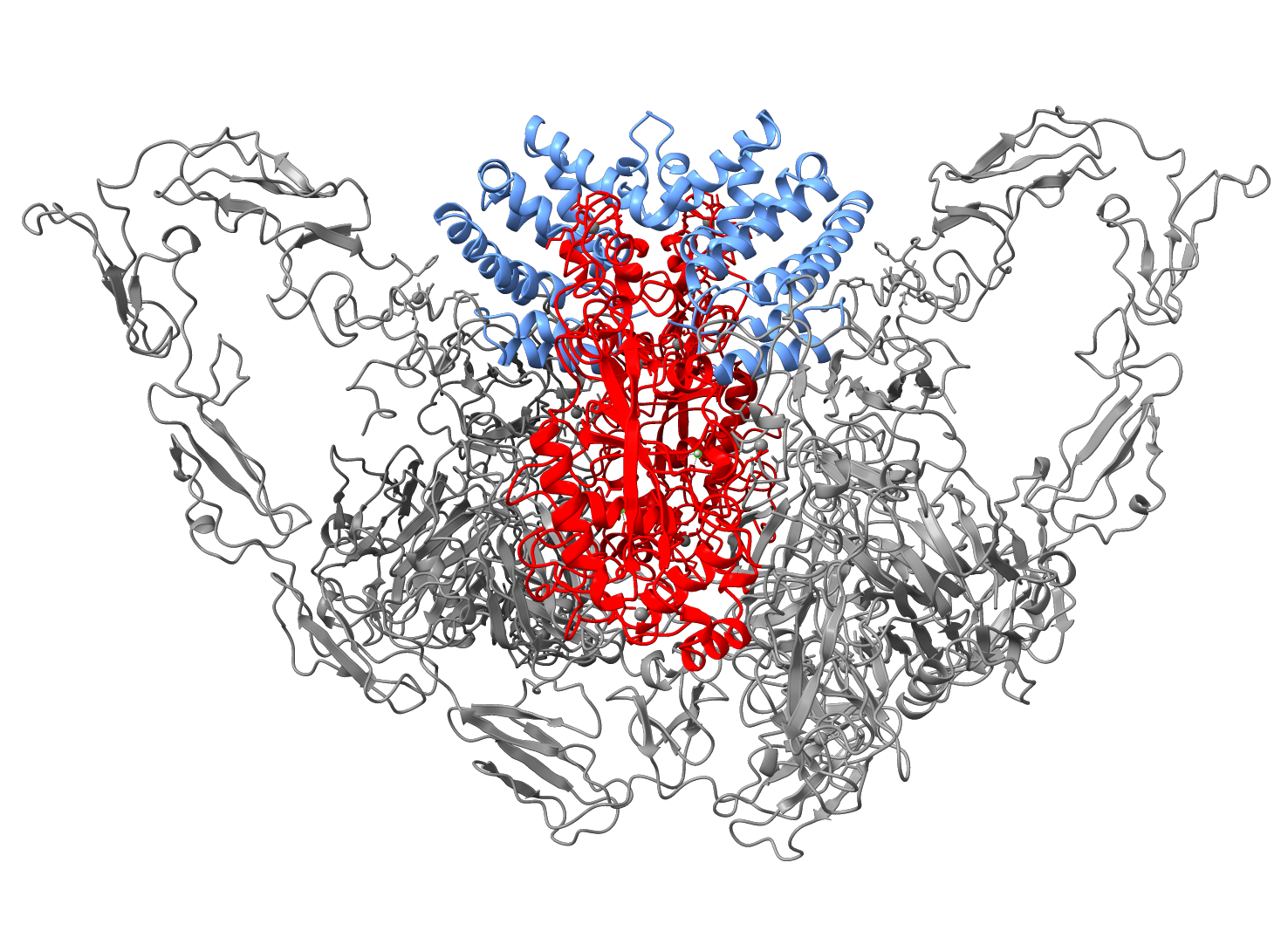
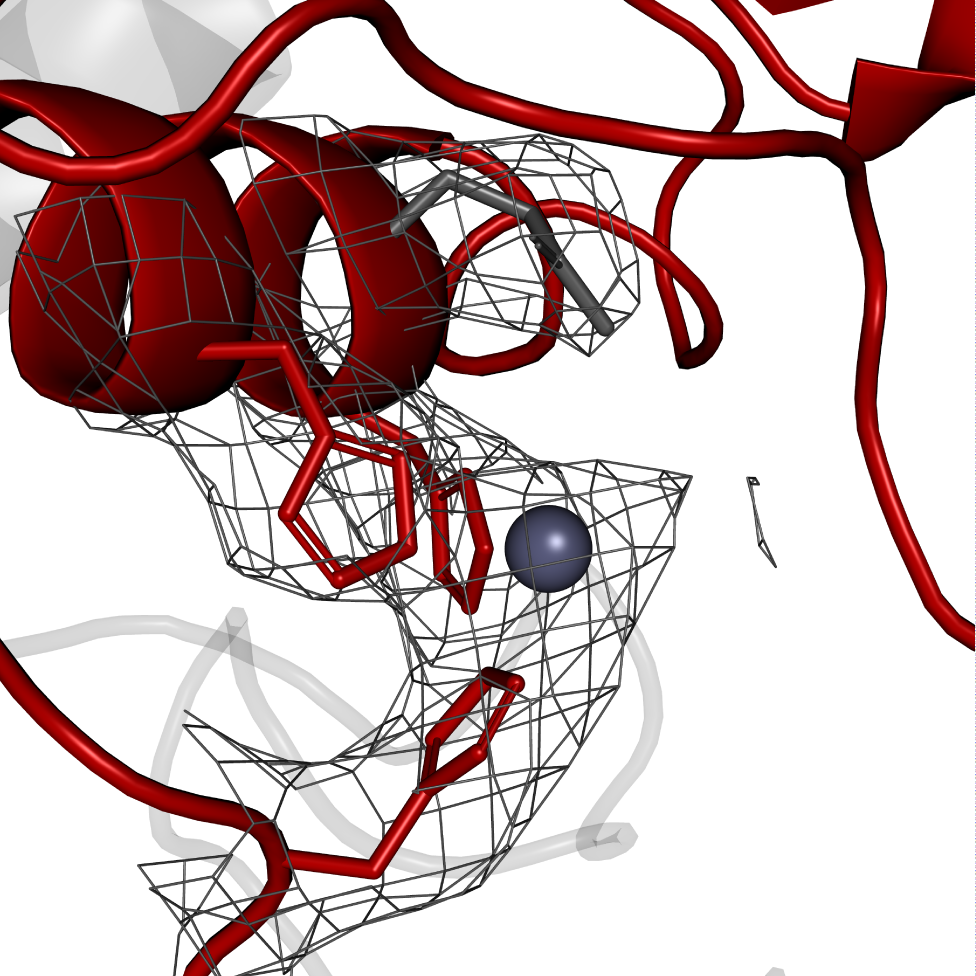
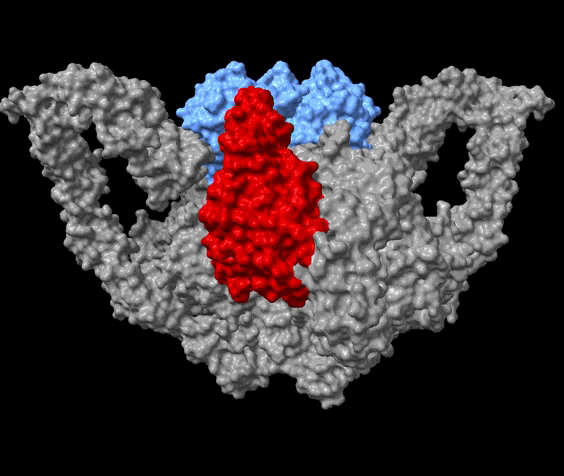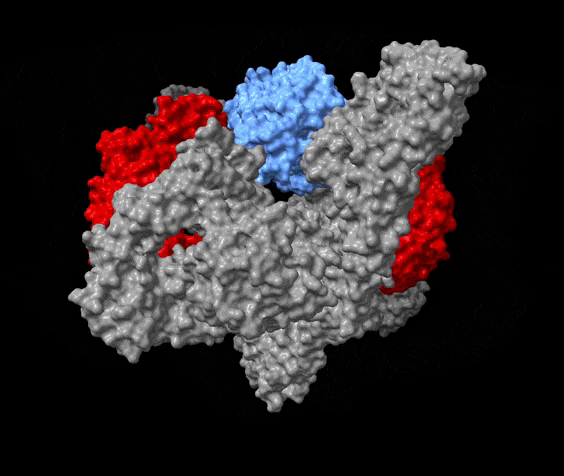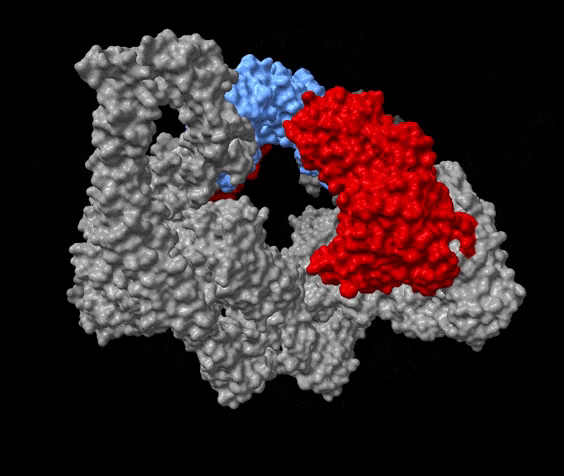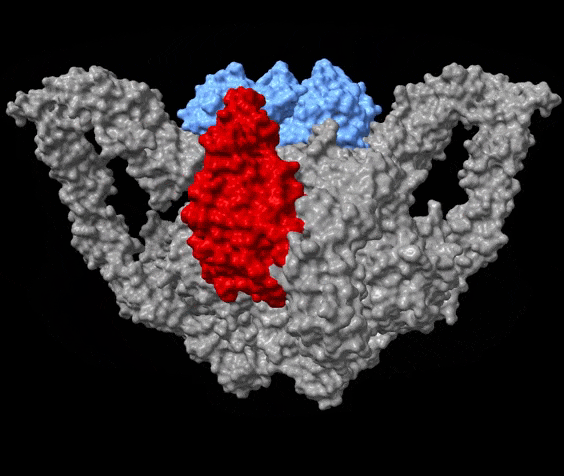
Vækstfaktoren IGF spiller en nøglerolle i menneskers højdevækst – i fravær af dens aktivitet bliver vi dværge. Senere i livet er IGF involveret i udviklingen af aldersrelaterede sygdomme, fx cancer og hjerte-kar-sygdomme, så hvad man først mente var en tro følgesvend er i virkeligheden det modsatte. Både under vækst og i forbindelse med sygdom skal IGF bringes fra en inaktiv til en aktiv form. Det proteolytiske enzym PAPP-A er i stand til at gøre netop dette.
”For syv år siden opdagede vi, at proteinet STC2 er i stand til at blokere for PAPP-A’s aktivitet og derved indirekte hæmme aktiviteten af IGF-vækstfaktoren. For at blokere skal STC2 danne et kompleks med PAPP-A. Det er dét kompleks, vi har studeret. Nu ved vi, hvordan dets tredimensionelle struktur ser ud,” forklarer professor Claus Oxvig.
”Det er fascinerende at se, hvordan et molekyle, vi biokemisk kender rigtig godt, faktisk ser ud. PAPP-A har en smuk, hjerteformet facon og et indre ’kammer’ – og det er selvfølgelig helt tilfældigt, selvom hjerte-kar-sygdomme er et af de områder, hvor PAPP-A er interessant. Men det er ikke selve den ydre form, som er forskningsmæssigt vigtig. Det er den måde, hvorpå de enkelte elementer af molekylet har indbyrdes kontakt. Selve maskineriet.”
Den erkendelse, at vækstfaktoren IGF fremmer højdevækst, daterer helt tilbage til 1957. Først senere opdagede man, at IGF også har uønskede funktioner i forbindelse med sygdom. Sommetider siger man What doesn’t kill you, makes you stronger. Det er anderledes med IGF. Lidt spøgefuldt kunne man sige IGF first makes you stronger, then it kills you.
Hjælp fra mus og mennesker
Der er stadig mange ubesvarede spørgsmål om de molekylære mekanismer, der bestemmer, hvor meget IGF, der bringes på den aktive form. Det er sandsynligt, at hastigheden hvormed STC2 er i stand til at danne komplekset med PAPP-A er nøje reguleret. Netop denne hypotese understøttes af tidligere studier, som viser, at naturligt forekommende varianter af STC2 i mennesker, hvor blot en enkelt aminosyre er skiftet ud, danner komplekset med PAPP-A en smule langsommere. Konsekvensen heraf er, at PAPP-A kan aktivere lidt mere IGF, hvilket resulterer i en forøget højde på op til 2,1 cm.
”Men for at forstå PAPP-A, STC2 og hvordan IGF reguleres, er vi afhængig af flere forskellige eksperimentelle systemer. For eksempel understøttes PAPP-A’s rolle som aktivator af IGF også af eksperimenter med mus, som har fået fjernet genet, der koder for PAPP-A. Størrelsen af musene er reduceret med 40%. Til gengæld lever de næsten 40% længere og modstår en række forskellige sygdomme. Det er meget fristende at tænke, at pengene så passer, men der er stadig mange ubesvarede spørgsmål. Med den struktur af PAPP-A·STC2-komplekset, vi lige har opnået, kigger vi direkte ind i maskinrummet. Vi opnår en bedre forståelse af biologien, og vi kan potentielt udvikle måder, hvorpå den kan manipuleres i forbindelse med sygdom, dvs. nye typer af lægemidler,” udtaler Claus Oxvig.
Førsteforfatter på artiklen, som rapporterer PAPP-A-strukturen, Sara Dam Kobberø, cand. scient. i molekylær medicin, har som ph.d.-studerende benyttet metoden kryo-elektronmikroskopi (cryo-EM) for at bestemme strukturen af det store proteinkompleks. Danmarks nationale Cryo-EM facilitet (EMBION, AU) har muliggjort studiet, som også er foregået med deltagelse af forskere på Københavns Universitet.
SUPPLERENDE OPLYSNINGER, HERUNDER KONTAKTOPLYSNINGER
Vi bestræber os på, at alle vores artikler lever op til Danske Universiteters principper for god forskningskommunikation. På den baggrund er artiklen suppleret med følgende oplysninger:
PUNKTER | INDHOLD OG FORMÅL |
Studietype | Eksperiment |
Ekstern finansiering | Dette arbejde er blevet støttet af Independent Research Fund Denmark, The Carlsberg Foundation, The Novo Nordisk Foundation |
Interessekonflikt | Der er indsendt en patentansøgning i forbindelse med projektet. |
Link til den videnskabelige artikel | Sara Dam Kobberø, Michael Gajhede, Osman Asghar Mirza, Søren Kløverpris, Troels Rønn Kjær, Jakob Hauge Mikkelsen, Thomas Boesen & Claus Oxvig Department of Molecular Biology and Genetics, Aarhus University, DK-8000 Aarhus C, Denmark (SDK, SK, TRK, JHM, CO), Interdisciplinary Nanoscience Center, Aarhus University, DK-8000 Aarhus C (TB), and Department of Drug Design and Pharmacology, University of Copenhagen, DK-2100 Copenhagen Ø, Denmark (MG, OAM). Structure of the proteolytic enzyme PAPP-A with the endogenous inhibitor stanniocalcin-2 reveals its inhibitory mechanism Nature Communications |
Kontakt- information | Professor Claus Oxvig
|
