Studie af en naturligt forekommende hæmmer af sygdomsfremkaldende enzymer
Et forskerhold med base i Danmark har opnået resultater, der kan være et skridt mod bekæmpelsen af protease-relaterede sygdomme såsom influenza, hudsygdomme og kræft ved at udnytte en naturligt forekommende proteasehæmmer.
Proteaser er enzymer, der spalter andre proteiner, hvorved disse enten aktiveres eller inaktiveres. Fejl og mangler ved specifikke proteaser kan føre til alvorlige sygdomme. Ved at forstå og derved potentielt udnytte naturligt forekommende proteasehæmmere, har man håb om at udvikle effektive behandlingsformer mod sygdomme forårsaget af overaktivitet af bestemte proteaser.
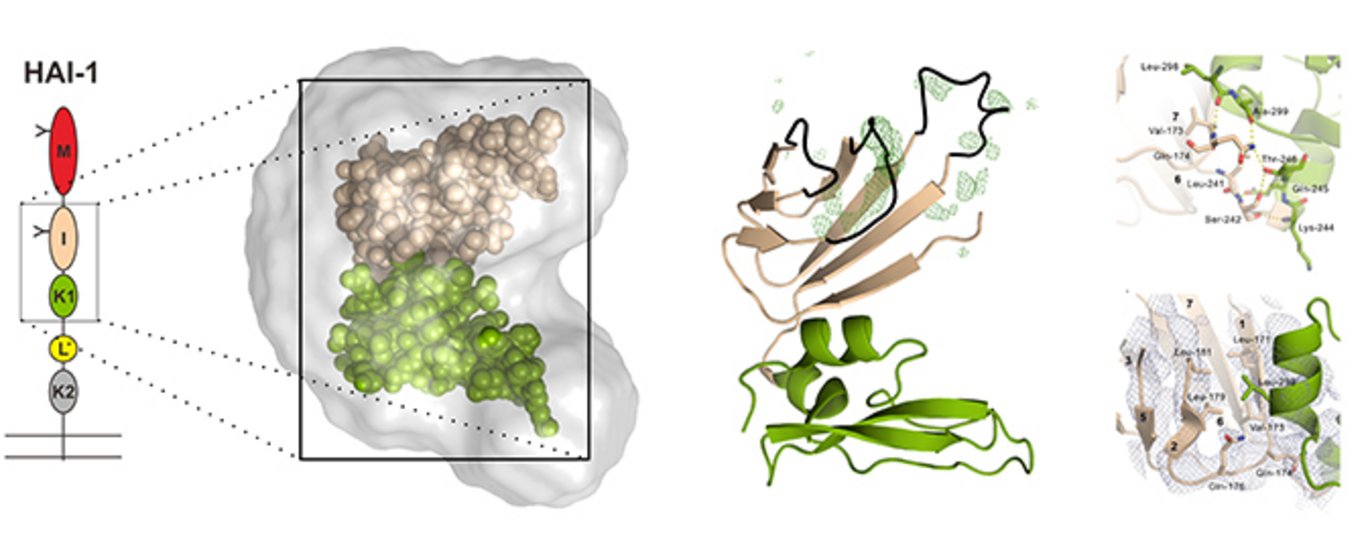
Mere specifikt har forskerholdet studeret en proteasehæmmer kaldet HAI-1 (hepatocyte growth factor activator inhibitor-1), der har stor betydning for normal udvikling. At HAI-1 er et essentielt protein, er tydeliggjort ved, at genmodificerede mus som mangler HAI-1 dør i livmoderen som følge af moderkagedefekter. At dette skyldes fejlreguleret ekstracellulær proteaseaktivitet kan ses ved, at musefostrene fødes når proteinudtrykket af målproteasen matriptase samtidigt fjernes. Netop matriptase vides at spille en vigtig rolle i flere alvorlige hudsygdomme, for udviklingen af influenza vira i kroppen samt for kræft. Ændres den naturlig balance mellem matriptase og HAI-1 til fordel for proteaseaktivitet, medfører dette til kræft i mus. Denne ubalance genfindes ligeledes i de fleste kræftknuder i mennesket. Derfor er den proteolytiske aktivitet af matriptase et lovende mål for medicinsk behandling.
Foruden det N-terminale MANEC domæne som forskerholdet for nyligt karakteriserede med NMR, findes der i HAI-1’s ekstracellulær del endnu et ikke-karakteriseret domæne, det såkaldte ”interne” domæne. Foruden dette findes også to såkaldte Kunitz-type hæmmer domæner (Kunitz), hvoraf Kunitz-1 varetager HAI-1’s proteasehæmmende funktion. Et Kunitz er i literaturen generelt beskrevet som en separat og funktionelt uafhængig enhed.
Ved at løse røntgenproteinkrystalstrukturen af et HAI-1 fragment, der dækker over det ukendte interne domæne og Kunitz-1, er det blevet afsløret at det interne domæne tilhører den relative ubeskrevne familie af polycystic kidney disease (PKD) domæner, men også hvorledes netop det interne domæne binder til nabodomænet Kunitz-1. Støttet af væskefase teknikken småvinkelrøntgenspredning og en kombination af mutagenese af udvalgte aminosyrer samt proteinfunktions-baserede eksperimenter, lykkedes det forskerne at vise, hvorledes disse inter-domæne vekselvirkninger ikke kun stabiliserer det interne domænes foldede struktur, men også hvorledes hæmningsaktiviteten af Kunitz-1 stimuleres.
Ved at afslutte deres strukturelle karakterisering af HAI-1’s indtil nu ukendte N-terminal region, har forskerne tilvejebragt ny viden om den tætte forbindelse mellem tertiær struktur og den overordnede aktivitet for en multidomæne proteasehæmmer. En hidtil uset mekanisme er blevet præsenteret, hvor binding af et nabodomæne kan stimulere hæmningsaktiviteten af en Kunitz hæmmer. Den nye struktur repræsenterer den først beskrevne intra-molekylære binding mellem et Kunitz og et andet domæne. Med udgangspunkt i denne nye viden håber forskerne på, at resultaterne kan lede til nye måder for medicinsk bekæmpelsen af protease-relaterede sygdomme ved at udnytte naturligt forekommende proteasehæmmere.
Resultaterne er offentliggjort i det internationale tidsskrift Journal of Biological Chemistry (JBC) med titlen: Crystal Structure of a Two-Domain Fragment of Hepatocyte Growth Factor Activator Inhibitor-1: Functional Interactions between the Kunitz-Type Inhibitor Domain-1 and the Neighboring Polycystic Kidney Disease-like Domain.
Mere information
Lektor Jan K. Jensen
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
jkj@mbg.au.dk - 87155542
