Tre-lags kontrol af mRNA-haler
Forskere fra Aarhus, Cambridge og Warszawa har i et fælles forskningsprojekt karakteriseret, hvordan de vigtige mRNA poly(A)-haler syntetiseres i bagegær. Undersøgelsen afslører overlappende mekanismer, der styrer poly(A)-halens længde og hermed sikrer stabiliteten af cellens genekspression.
Som navnet antyder, fungerer messenger-RNA'er (mRNA'er) som informationstransmittere ved at overføre genetisk information fra DNA til dets translation til protein. I eukaryote organismer, herunder mennesker, planter og svampe, bærer 'bagenden' af mRNA -molekylet et ’vedhæng’ med gentagne enheder af adenosiner, A’er, som er et af de fire alfabeter i den genetiske kode. Denne unikke struktur, poly(A)-halen, er afgørende for, at mRNA'et kan komme gennem cellekernen til ribosomerne i cytoplasmaet, hvor proteinsyntesen finder sted.
Poly(A)-halen er en dynamisk struktur, som bliver kortere, efterhånden som mRNA -molekylet ældes. Når poly(A)-halen fjernes, ved hjælp af cytoplasmatiske enzymer, virker det som en timer, eller en sikring, der udløser mRNA’ets nedbrydning. Dette giver således mulighed for cellulær mRNA-homeostase, der sikrer, at den rigtige mængde mRNA er tilgængelig for ribosomerne.
For at et sådant system kan fungere effektivt, skal poly(A)-halerne have en præcis længde, når de ankommer til cytoplasmaet og derfor også, når de fremstilles i kernen. Dette er også tilfældet, og artsspecifikke poly(A)-halelængder eksisterer, der varierer fra ~60 A’er i encellede svampe til ~250 A’er i humane celler.
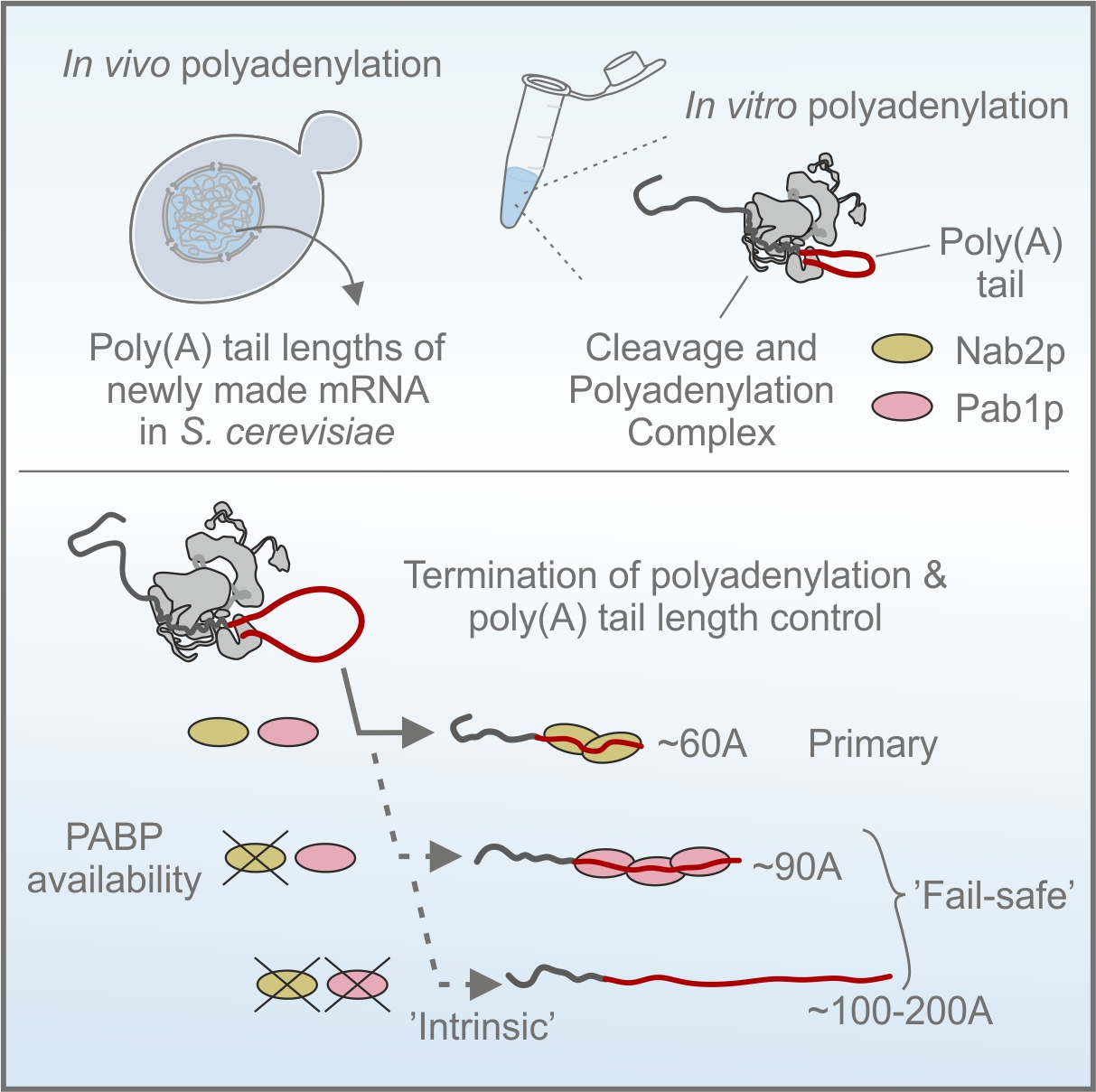
Instruktionerne til fremstilling af poly(A)-haler er imidlertid ikke indkodet i DNA-sekvensen, sammen med resten af mRNA’et; i stedet tilføjer et dedikeret molekylært maskineri, kaldet 'Cleavage and Polyadenylation Factor (CPF)', poly(A)-haler til nyligt producerede mRNA'er med hjælp fra associerede faktorer. Men hvordan opnås den præcise poly(A)-halelængde, når den ikke instrueres af DNA'et?
Forskerne gjorde et overraskende fund
I en ny undersøgelse, der netop er offentliggjort i tidsskriftet Genes & Development, gjorde forskere fra Aarhus, Cambridge og Warszawa det overraskende fund, at mere end én nedbrydningsvej viser sig at kontrollere poly(A)-halelængder i Saccharomyces cerevisiae, der er en encellet gær, der bliver flittigt brugt til bagning og ølbrygning, men også er en uvurderlig forsøgsorganisme i molekylærbiologiske laboratorier verden over.
Oprindeligt gav manipulation af individuelle reaktionsveje, der var under mistanke for at regulere poly(A)-hale syntese, kun ringe indvirkning på halelængden, hvilket antydede, at overlappende mekanismer var på spil. Ved omhyggelige undersøgelser fandt forskerne frem til, at tre separate mekanismer synes at styre længden af poly(A)-haler. To af disse udføres af såkaldte 'poly(A)-bindende proteiner (PABP'er), som associerer med mRNA poly(A)-haler i cellekernen og instruerer CPF-maskineriet i at afslutte sin halesyntese. Den tredje af de identificerede reaktionsveje var særligt overraskende, da den slet ikke kræver PABP'er, men i stedet bruger en indbygget egenskab i CPF-maskineriet til selv at afslutte poly(A)-hale syntesen. Når alle tre kontrolsystemer ikke fungerer samtidigt, vokser poly(A)-haler eksplosivt, ??hvilket går ud over de pågældende mRNA’ers protein produktion.
De opnåede resultater er et godt eksempel på, hvordan kritiske processer i naturen ofte har op til flere backup-systemer. I tilfælde af poly(A)-halesyntese er sådanne 'fejlsikrings'-mekanismer sandsynligvis udviklet for at kompensere for naturlige udsving i tilgængeligheden af PABP'er. Ved at bruge alternative biokemiske veje sikrer cellerne sig derfor, at overførslen af genetisk information ikke standser, blot fordi en faktor svigter midlertidigt.
Den videnskabelige artikel er offentliggjort i det internationale tidsskrift Genes & Development:
Matti Turtola, M. Cemre Manav, Ananthanarayanan Kumar, Agnieszka Tudek, Seweryn Mroczek, Pawe? S. Krawczyk, Andrzej Dziembowski, Manfred Schmid, Lori A. Passmore, Ana Casañal and Torben Heick Jensen
“Three-layered control of mRNA poly(A) tail synthesis in Saccharomyces cerevisiae”
DOI: https://doi.org/10.1101/gad.348634.121
Mere information
Postdoc Matti Turtola – mt@mbg.au.dk - 2475 1713
Professor Torben Heick Jensen – thj@mbg.au.dk – 6020 2705
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
