Tværfagligt aarhusiansk forskerteam opdager ny kontrolmekanisme i det medfødte immunsystem
Til trods for at vi har proteinet ITIH4 i store mængder i blodet, har dets funktion hidtil været ukendt. Nu har et team af forskere fra Institut for Biomedicin og Institut for Molekylærbiologi og Genetik ved at kombinere mange forskellige teknikker opdaget, at ITIH4 hæmmer enzymer kaldet proteaser i det medfødte immunsystem og dette via en hidtil ukendt mekanisme. Forskningsresultaterne er netop publiceret i det ansete videnskabelige tidsskrift <em>Science Advances</em>.
Proteaser er enzymer, som kløver andre proteiner. Oftest forekommer proteaser i netværk kaldet kaskader, hvor en bestemt hændelse udløser en kædereaktion, hvor et antal proteaser kløver og derved aktiverer hinanden. Mest kendt er nok koagulationskaskaden, som sørger for størkning af vores blod, når der går hul på en blodåre.
Men et lignende netværk af proteaser kaldet komplementsystemet findes i vores blod og i vævene. Aktivering af komplementsystemet medfører eliminering af sygdomsfremkaldende organismer, cancerceller og vores egne døende celler. For at undgå at komplementsystemet angriber raske celler, holdes det under skarp kontrol af proteiner, som inaktiverer proteaserne efter kort tid; disse kontrolproteiner kaldes protease-inhibitorer/-hæmmere.
På Institut for Biomedicin ønskede professor Steffen Thiel og ph.d.-studerende Rasmus Pihl at undersøge, hvilke andre proteiner i vores blod de såkaldte MASP proteaser fra komplementkaskaden vekselvirker med. Med hjælp fra massespektrometri-gruppen på Institut for Molekylærbiologi og Genetik ledet af professor Jan J. Enghild fandt de overraskende ud af, at MASP dannede et stærkt kompleks med ITIH4-proteinet.
ITIH4 danner et kompleks med enzymerne MASP-1 og MASP-2
”Det var en stor overraskelse, da jeg så de første data fra vores samarbejdspartnere, som viste, at ITIH4 kunne danne et kompleks med enzymerne MASP-1 og MASP-2. På Biomedicin har vi studeret de to proteaser i 25 år, og ITIH4 har simpelthen aldrig været på radaren. Men det gav god mening, da proteiner, som ligner ITIH4, fungerer som inhibitorer af andre proteaser,” fortæller Rasmus Pihl.
Rasmus og Steffen begyndte nu en systematisk undersøgelse af, hvordan ITIH4 påvirker MASP-1 og MASP-2. Det viste sig, at når ITIH4 dannede et kompleks med enzymerne MASP-1 og MASP-2, kunne disse stadigt kløve små proteiner, mens store proteiner ikke kunne kløves, når ITIH4 inhiberede MASP-1 og MASP-2.
Den opdagelse fik kollegaerne Jan J. Enghild og Gregers R. Andersen på Institut for Molekylærbiologi og Genetik op af stolene. Siden 1980’erne har forskere på instituttet karakteriseret en anden protease-inhibitor kaldet A2M, som har netop denne egenskab. Havde kollegaerne på Biomedicin nu opdaget, at ITIH4 ligner A2M?
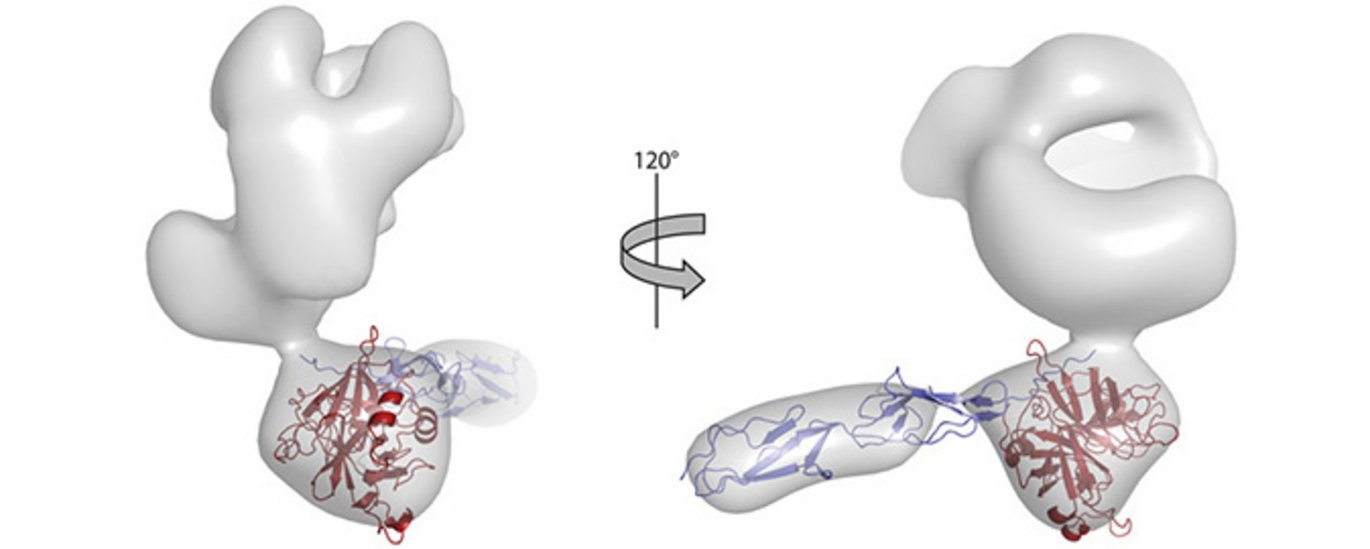
For at karakterisere i detaljer hvorledes ITIH4 inhiberer MASP proteaserne, isolerede Rasmus Pihl både frit ITIH4 og ITIH4 bundet til MASP-1 proteasen. Disse prøver studerede postdoc Rasmus Kjeldsen Jensen og professor Gregers Rom Andersen på Molekylærbiologi og Genetik vha. røntgensmåvinkelspredning og elektronmikroskopi. De kunne vise, at ITIH4 danner kontakt med MASP-1 proteasen via et såkaldt von Willebrand domæne, hvilket passede nydeligt med resultaterne fra Institut for Biomedicin. Dette er en helt ny mekanisme for inhibering af proteaser, helt forskellig fra den måde A2M inhiberer proteaser.
”Der er meget lidt viden om ITIH4, men det er kendt, at ved forskellige patologiske tilstande kan der ske en kløvning af proteinet. Vores resultater viser, at en sådan kløvning er helt nødvendig for, hvorledes ITIH4 kan fungere som enzyminhibitor ,” uddyber professor Steffen Thiel. ”
Gregers Rom Andersen forklarer: ”Ved at anvende cryo-elektronmikroskopi forsøger vi nu at forstå i detaljer, hvorledes ITIH4 inhiberer MASP-1 og MASP-2 via denne nye inhiberingsmekanisme. Vi ved allerede nu, at når ITIH4 kløves, danner den kompleks med både MASP-1 og et andet ITIH4 molekyle. Vi er meget spændte på at se, hvordan det foregår”.
Winston Churchill udtrykte på et tidspunkt: ”Men occasionally stumble over the truth, but most of them pick themselves up and hurry off as if nothing ever happened. ”Som forsker er det helt nødvendig at bevare nysgerrigheden. Det er dybt fascinerende at arbejde med proteiner og mekanismer, der er helt nye og ubeskrevne. Dette gør så også, at vi ikke ved, hvor vi ender med hensyn til at beskrive, om ITIH4 har en betydning i forbindelse med kliniske situationer,” udtaler Steffen Thiel.
De nye resultater har udløst en bevilling fra Novo Nordisk Fonden til at forsætte samarbejdet mellem de to institutter.
Artiklen var offentliggjort i den videnskabelige artikel Science Advances:
ITIH4 acts as a protease inhibitor by a novel inhibitory mechanism
Rasmus Pihl, Rasmus K. Jensen, C. Poulsen, Lisbeth Jensen, Annette G. Hansen, Ida B. Thøgersen, József Dobó, Péter Gál, Gregers R. Andersen, Jan J. Enghild and Steffen Thiel
Mere information
Professor Steffen Thiel
Institut for Biomedicin, Aarhus Universitet
st@biomed.au.dk - 2927 0890
Professor Gregers Rom Andersen
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
gra@mbg.au.dk - 30256646
