Bakteriernes hemmelige våben mod pesticider og antibiotika afsløret
Bakterier udviser en ekstrem tilpasningsevne, der sætter dem i stand til at overleve under de mest ubarmhjertige forhold. Nye forskningsresultater produceret af danske og britiske forskere afslører nu de molekylære detaljer bag ét af bakteriernes hemmelige våben i kampen for overlevelse under meget næringsfattige og endog giftige forhold.
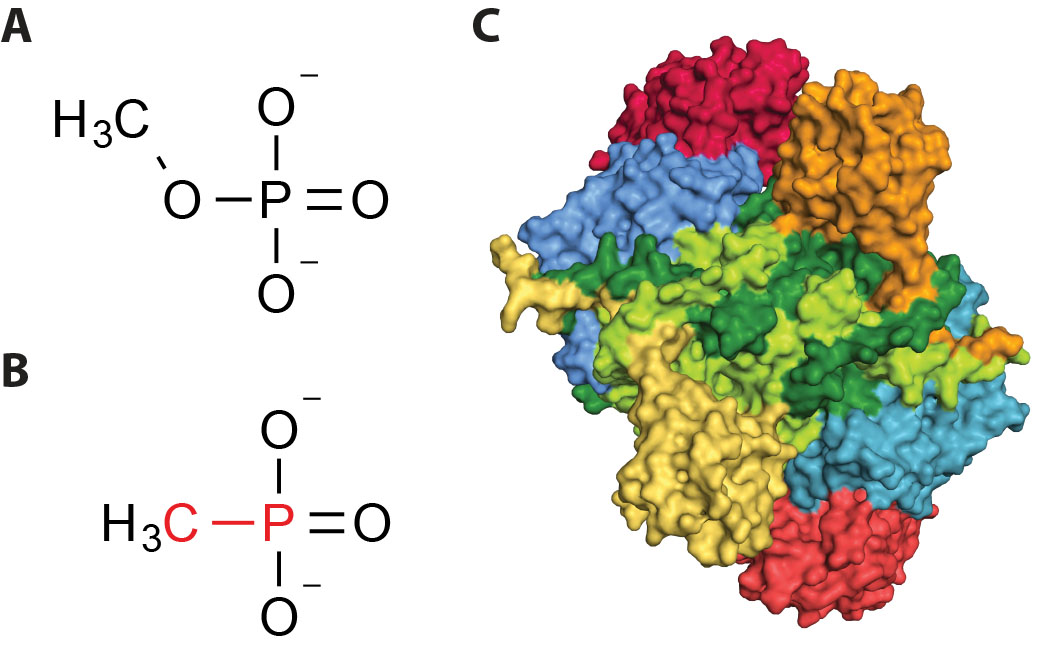


Alt liv har brug for fosfat for at vokse, og derfor benyttes der årligt på verdensplan flere hundrede mio. tons fosfatholdig gødning i landbruget. I verdenshavene er næringsindholdet mange steder så lavt, at al vækst standses, og bakterier har derfor udviklet avancerede mekanismer til at udvinde fosfat fra andre stoffer, de såkaldte fosfonatforbindelser, der produceres af mange, primitive organismer og udgør det største, kendte fosforlager i havet (se figur). Mange af disse forbindelser dannes som giftstoffer (antibiotika) som led i den stadige kamp for overlevelse blandt marine organismer. Inden for landbruget anvendes årligt flere mio. kilo af fosfonatforbindelsen glyphosat (RoundUp™) som pesticid, og ophobning af restprodukter af dette stof i grundvandet har været årsag til stigende bekymring inden for de seneste år.
Bakterier, der er i stand til at omdanne fosfonatforbindelser til fosfat til brug for øget vækst, har udviklet et arsenal på 14 proteiner til formålet, hvoraf ca. halvdelen er enzymer, der kræves for den kemiske omdannelse af stofferne. Fem af disse enzymer samler sig i cellerne i et stort kompleks kaldet C-P lyase kernekomplekset, der er i stand til at katalysere to ud af de i alt fem reaktioner, der kræves for at fosfonatforbindelsen kan benyttes til vækst.
Et internationalt hold bestående af forskere fra både Institut for Molekylærbiologi og Genetik ved Aarhus Universitet og Medical Research Council, Cambridge i England har nu bestemt den præcise, molekylære opbygning af C-P lyase kernekomplekset, hvilket for første gang sætter os i stand til at forstå, hvordan bakteriernes hemmelige våben fungerer. Ved hjælp af teknikkerne røntgenkrystallografi og elektronmikroskopi har forskerne været i stand til at opnå en ekstremt detaljeret indsigt i opbygningen af fire af enzymerne samt placeringen af det femte enzym i komplekset.
Resultaterne er netop publiceret i det meget velansete tidsskrift Nature og forventes at revolutionere vores forståelse af, hvordan bakterier kan overleve under strenge, naturlige forhold samt deres evne til at nedbryde visse antibiotika. På længere sigt kan resultaterne potentielt benyttes til at udvikle teknikker til fjernelse af pesticidrester i drikkevand, undgå bakteriel resistens mod antibiotika samt forstå, hvordan drivhuseffekten forårsages, idet en stor del af udledningen af drivhusgassen methan skyldes bakteriel omdannelse af methylfosfonat i verdenshavene.
Link til den videnskabelige artikel i Nature: Structural insights into the bacterial carbon–phosphorus lyase machinery, Paulina Seweryn, Lan Bich Van, Morten Kjeldgaard, Christopher J. Russo, Lori A. Passmore, Bjarne Hove-Jensen, Bjarne Jochimsen & Ditlev E. Brodersen
Mere information
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
deb@mbg.au.dk - 2166 9001
