Danskere på vej mod revolutionerende kræftmedicin
Danske forskere har i samarbejde med forskere fra Johns Hopkins University og biotekfirmaet Genspera i USA udviklet en ny medicin mod prostatakræft.
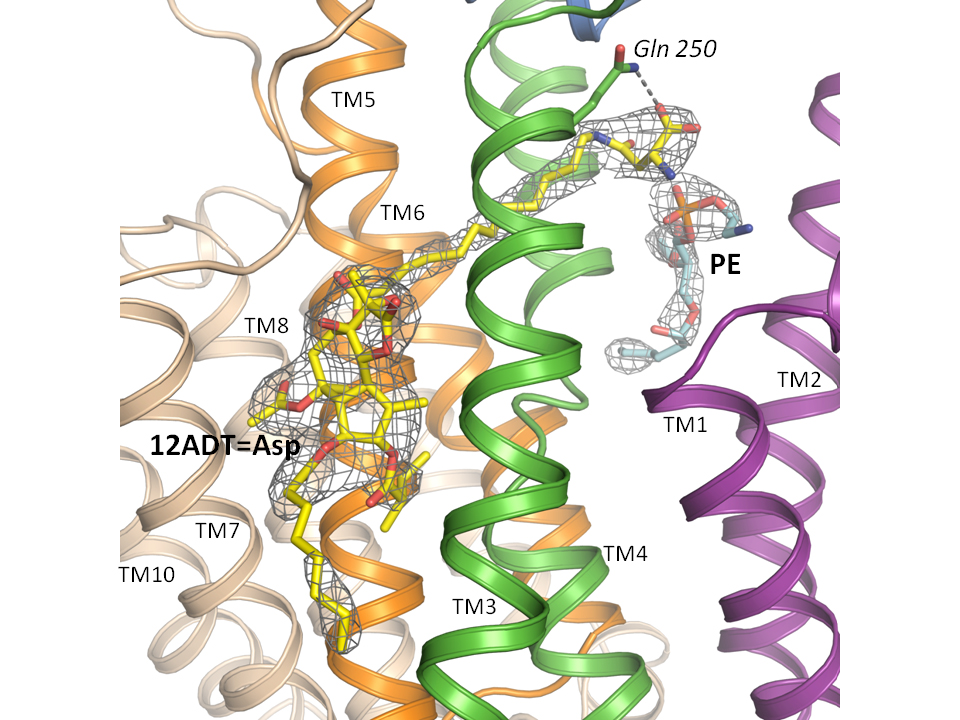
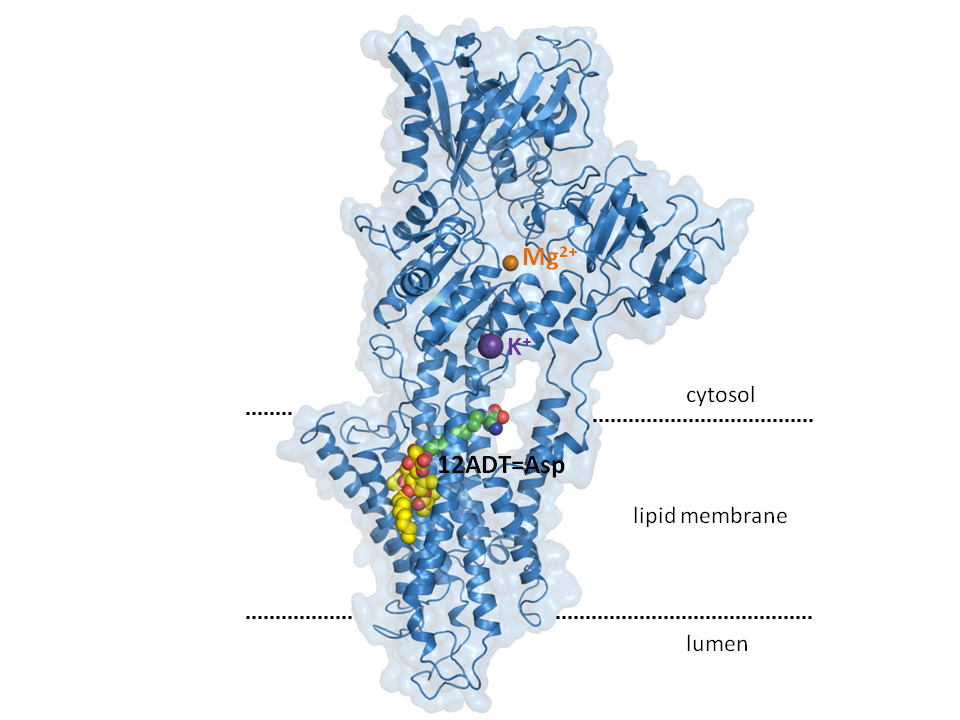
Hjørnestenen i den nye kræftmedicin er stoffet thapsigargin, der stammer fra en middelhavsplante, der gror på blandt andet Ibiza.
Medicinen bliver i øjeblikket testet på mennesker, og succes i forsøgene kan åbne op for helt nye muligheder i kampen mod ellers uhelbredelige former for kræft.
Resultaterne af den nye forskning er netop offentliggjort i det velansete videnskabelige tidsskrift Science Translational Medicine.
Verdensførende forskere tæt på medicin
»Det er rart, for en gangs skyld at kunne sige, at vi er tæt på målet, når det handler om at udvikle ny medicin mod kræft. Den nye medicin har vist meget lovende resultater i dyreforsøg, og bliver resultaterne genskabt i mennesker, kan det hurtigt udvikle sig til et lægemiddel og en helt ny vej for fremtidig kræftbehandling,« fortæller professor Poul Nissen, centerleder for grundforskningscentret Pumpkin ved Aarhus Universitet, der er en del af den internationale forskergruppe bag de nye lovende resultater.
Poul Nissen fortæller desuden, at det er ikke uden grund, at danske forskere har del i et så opsigtsvækkende internationalt studie.
»Vi er verdensførende i at kortlægge lægemidlers funktion på det atomare niveau. Men dette har kun kunnet lade sig gøre, fordi vi har et fantastisk samarbejde mellem Claus Olesen og Jesper Vuust Møller fra Institut for Biomedicin og Ingrid Dach og jeg selv fra Institut for Molekylærbiologi og Genetik. Udviklingen af medicin i den forstand er som at lege med legoklodser. Vi kigger på, hvordan medicinen virker og kan herefter manipulere med forskellige funktioner, der gør medicinen endnu bedre. Det har som her givet os muligheden for at lave medicin, der virker på former for kræft, vi ikke har kunnet stille noget op imod før,« siger han.
Forskerne forsøger netop nu at få blandt andet mosser og gær til at danne thapsigargin, så de har nok af stoffet til at producere medicinen i stor skala.
Medicin får kræft til at begå selvmord
Centralt i den nye behandlingsform er alle cellers behov for at kontrollere niveauet af calcium i cellen og i dens forskellige småorganer kaldet organeller.
Hvis ikke cellerne har styr på calciumkoncentrationen, aktiveres nogle mekanismer i cellen, som i sidste ende får den til at begå selvmord.
Forskerne bag den nye medicin understreger, at der statistisk stadig kun er 10 procents chance for, at medicinen virker i patienter med uhelbredelige kræftsygdomme. En tommelfingerregel er, at der går op mod 10 år, fra et stof er succesfuldt testet på mennesker, til det kan bruges som medicin i stor skala.
Dette er kroppens naturlige forsvar mod blandt andet beskadigede celler, der potentielt kan udvikle sig til kræft. Derfor har calciumsignalering længe været et ønsket mål for kræftforskere.
»Calcium er et af de centrale stoffer i cellernes regulering af forskellige enzymatiske processer. Når cellen finder ud af, at calciumniveauet er ude af kontrol, begår den derfor selvmord. Den nye medicin, G202, er designet til at smadre calciumreguleringen specifikt i kræftceller ved at tilføre dem giftstoffet thapsigargin og på den måde få dem til at tage livet af sig selv,« fortæller Poul Nissen.
Aggressiv kræft åbner døren for ny behandling
Kontrol over calciumkoncentrationen er central for alle celler i kroppen og ikke bare for kræftceller. Derfor er det ikke muligt blot at give kræftpatienter stoffer, som thapsigargin. Gjorde man det, ville mange andre celler i kroppen også dø. Derfor har forskerne udviklet en metode til at få stoffet målrettet direkte mod kræftceller.
Her åbnede prostatakræft selv dørene for medicinen.
»Cancerceller danner et væld af aggressive enzymer, såkaldte proteaser (se faktaboks), for at nedbryde og omdanne det omgivende væv. Det gør kræftceller helt generelt for at skabe mere plads til øget vækst. Det åbnede for ideen om at sætte thapsigargin på små stykker proteiner, der er mål for nedbrydning ved disse kræftcelleproteaser. Dette frembragte stoffet G202.«
Fakta
Proteaser er enzymer, der kan splitte proteiner ad på specifikke steder og nedbryde det i mindre komponenter. Proteaserne er ofte meget specifikke og nedbryder ikke ukritisk alle proteiner, men leder efter proteiner med en specifik aminosyresekvens i deres opbygning. Mange af vores fordøjelsesenzymer er proteaser, og de anvendes også i stor skala som tilsætning til vaskepulver, hvor de hjælper med at nedbryde pletter på tøjet.
»Det samlede molekyle i G202 er så stort, at det ikke kan trænge ind i cellerne og derfor ikke beskadiger kroppen. Men når G202 kommer i nærheden af en prostatakræftcelle, vil proteaserne klippe proteindelen af molekylet i stykker og således frigive thapsigargin.«
»Når thapsigargin frigøres, vil det hurtigt trænge ind i de nærmeste celler, det vil sige kræftcellerne. Derved rammer G202 kun prostatakræftceller, mens kroppens egne celler ikke bliver ramt. Kræftcellerne vil ganske enkelt suge det op og forberede deres egen død,« siger Poul Nissen.
G202 virker mod andre former for kræft
Da G202 potentielt kan spaltes af mange kræftcelletyper, forventes den nye medicin også at kunne angribe andre former for kræft end prostatakræft.
Proteasen, der spalter lægemidlet, er også til stede i de nye blodkar, som kræftsvulster danner for at sikre sig forsyning af næringsstoffer til de nydannede kræftceller. Ud over prostatakræft gælder dette også for eksempelvis brystkræft og blærekræft.
Lægemidlet spaltes derfor også i disse omkringliggende blodkar, og kræftsvulsterne kvæles ved manglende blodtilførsel udover at slå sig selv ihjel ved selvmord. Stoffet kan derfor vise sig at være effektivt mod flere former for kræft.
Fakta
Thapsigargin er en unik cellegift, der binder tæt til calciumpumpen SERCA i cellemembraner og blokerer dens funktion. Når SERCA bliver blokeret, kan cellen ikke opretholde koncentrationen af calcium i de intracellulære calciumlagre. Derefter vil cellen i løbet af cirka et døgn udløse programmeret selvmord (apoptose). Derfor kan thapsigargin bruges til få kræftcellen til at slå sig selv i ihjel.
Andre stoffer i kræftbehandling slår celler ihjel, mens de deler sig. Det er ikke muligt for nogle former for kræft blandt andet prostatakræft, der vokser langsomt. Fordelen ved thapsigargin er, at det dræber celler i alle deres faser, også de faser, hvor cellen ikke deler sig.
Hele det molekylære puslespil vedrørende koblingen af thapsigargin til proteiner har især professor MSO Søren Brøgger Christensen ved Institut for lægemiddeldesign og Farmakologi, Københavns Universitet, stået for.
G202 sætter calciumpumper ud af funktion
Calciumniveauerne i cellerne er kontrolleret af forskellige pumper i både de ydre og indre membraner.
De ydre membranpumper regulerer basalniveauet af calcium i cellen, mens de indre pumper som calciumpumpen SERCA opretholder indre calciumlagre. Det gør SERCA ved at pumpe calcium fra cellevæsken ind i lagrene, der således får et højt calciumindhold - som at pumpe luft ind i en trykbeholder og dermed opbygge et overtryk, som kan udløses ved behov.
Netop SERCA er målet for G202-forsøgsmedicinen.
Den funktionelle del af den nye medicin (thapsigargin) er i stand til at blokere for SERCA, så calcium langsomt siver ud i cellevæsken, men ikke pumpes tilbage, hvilket til sidst sætter selvmordsprocessen i gang. Derved dør kræftcellerne.
Engineering a Prostate-Specific Membrane Antigen–Activated Tumor Endothelial Cell Prodrug for Cancer Therapy
Samuel R. Denmeade1, Annastasiah M. Mhaka1, D. Marc Rosen1W. Nathaniel Brennen1Susan Dalrymple1, Ingrid Dach2Claus Olesen2Bora Gurel1, Angelo M. DeMarzo1, George Wilding3, Michael A. Carducci1, Craig A. Dionne4, Jesper V. Møller2,5, Poul Nissen2,6, S. Brøgger Christensen7 and John T. Isaacs1
-
The Sidney Kimmel Comprehensive Cancer Center, The Johns Hopkins University School of Medicine, Baltimore, MD 21231, USA.
-
Centre for Membrane Pumps in Cells and Disease (PUMPKIN), Danish National Research Foundation, DK-8000 Aarhus, Denmark.
-
University of Wisconsin, Madison, WI 52792, USA.
-
GenSpera Inc., San Antonio, TX 78258, USA.
-
Department of Biomedicine, Aarhus University, DK-8000 Aarhus, Denmark.
-
Department of Molecular Biology and Genetics, Aarhus University, DK-8000 Aarhus,Denmark.
-
Department of Medicinal Chemistry, University of Copenhagen, DK-2100 Copenhagen, Denmark
Link til artiklen i Science Translational Medicine
Mere information
Professor Poul Nissen
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
pn@mb.au.dk - 2899 2295
Kilde: Videnskab.dk
