Forskere afdækker ny basal viden om cellemembraner
Efter et tværfagligt samarbejde kan forskere på Aarhus Universitet præsentere en banebrydende metode til at studere cellemembraner. En større forståelse for kompleksiteten i membranernes funktion kan give forskerne nye ideer til udvikling af nye typer medicinsk behandling mod fx prostatakræft. Resultaterne er publiceret i det førende tidsskrift Nature Communications.


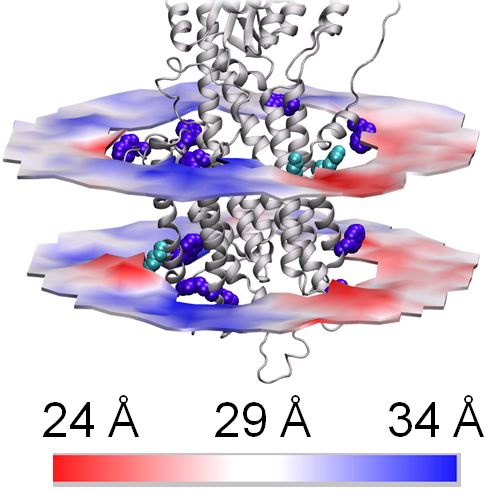
Ved at kombinere mange fagdiscipliner fra grundforskningscentrene PUMPKIN og inSPIN, har forskerne kastet nyt lys over cellemembraners struktur og funktion på grundlag af computerberegninger, som understøttes af eksperimentelle strukturstudier.
Celler og cellemembraner har været kendt lige siden mikroskopien blev opfundet, men i dag søger man at knytte overordnede observationer om celler og organismers fysiologi samt sundhed og sygdom til detaljer om molekylers struktur og funktion for at kunne forstå de basale processer, der definerer liv og samspil mellem gener og miljø.
Membraner omslutter celler og deres rumopdelinger, og er derfor afgørende for alt liv. De består af fedtstoffer og proteiner og er målet for ca. halvdelen af vore kendte lægemidler. Det komplekse samspil mellem protein og fedtstof i membranen har afgørende betydning for membranens funktion, men er meget vanskelig at studere med eksperimenter alene - dette er nu lykkedes for Aarhusforskerne ved kombination med computerbaserede beregninger. Herved er åbnet en port til ny indsigt i den molekylære cellebiologi.
En nyskabende kombination af røntgenkrystallografiske data indsamlet på røntgensynkrotronkilder og molekyldynamiske simuleringer udført på kraftige computere gav forskergruppen et unikt grundlag for at visualisere og studere sammenspillet mellem membranen og ”kalciumpumpen” - et membranprotein, som under store strukturændringer pumper kalcium over cellemembranen. Det var her af afgørende betydning, at man kunne vise, at eksperimenterne og de uafhængigt opstillede computermodeller gav forenelige resultater. Studiet tillader derfor en afklaring af spørgsmål om, hvordan membranproteiner er indlejret i cellemembraner og kan fx også anvendes til at studere lægemidlers effekt på membranproteiner.
”Vi opdagede, at vi på en gang kunne undersøge, hvordan et spændende membranprotein er indlejret i cellemembranen, og hvordan det ændrer sig, når det arbejder,” forklarer lektor Lea Thøgersen, der sammen med ph.d.-studerende Maria Musgaard stod for computerberegningerne i studiet.
”I forhold til tidligere, hvor man kun havde skematiske modeller, kan vi nu beskrive proteinets sammenspil med membranen i molekylær detalje, hvilket hjælper os til at forklare et vigtigt proteins funktion,” supplerer Maria Musgaard, og fortsætter ”Dette er afgørende for at forstå, hvordan cellers transportfunktioner ændres ved fx sygdomstilstande og af lægemidler.”
En større forståelse for denne kompleksitet i membranproteiners funktion kan give forskerne nye ideer i forbindelse med udviklingen af nye typer medicinsk behandling, såsom mod prostatakræft, hvor man netop har opmærksomheden henledt på kræftcellernes kalciumtransport – hvis denne blokeres, dør kræftcellerne nemlig.
Professor Jesper Vuust Møller, der i mange år har beskæftiget sig med kalciumtransport, udtaler i denne anledning: ”Det har jo altid været min drøm som forsker at kunne få nye ideer og indsigt i naturen, og samtidig som medicinsk forsker at kunne finde vejen til nye behandlingsmetoder mod vigtige sygdomme som prostatacancer”. Grundforskningscentret PUMPKIN udvikler prostatakræftforskningen i samarbejde med blandt andet københavnske, amerikanske og franske forskere.
”Det er kombinationen af mange fagdiscipliner, som har været afgørende for denne succeshistorie” udtaler PUMPKIN centerleder Professor Poul Nissen. ”Vi har bragt fysiologi, biofysik, molekylærbiologi og kemi sammen i dette projekt – det er i krydsfelter som disse, at spændende nye spørgsmål og indsigter opstår i disse år og fremover.”
Projektets tværfaglige karakter afspejles i sammensætningen af forskergruppen. Forfatterne er tilknyttet grundforskningscentrene PUMPKIN og InSPIN, fordelt på Molekylærbiologisk Institut, (Yonathan Sonntag og Poul Nissen), Kemisk Institut (Maria Musgaard og Birgit Schiøtt), Institut for Fysiologi og Biofysik (Claus Olesen og Jesper Vuust Møller) samt Bioinformatikcentret (Lea Thøgersen) - alle ved Aarhus Universitet.
Link til artiklen i Nature Communications
Mutual adaptation of a membrane protein and its lipid bilayer during conformational changes
-
- Yonathan Sonntag1,6, Maria Musgaard2,5, Claus Olesen3,5, Birgit Schiøtt2,6, Jesper Vuust Møller3,5, Poul Nissen1,5, Lea Thøgersen1,4,5
- 1Department of Molecular Biology, Aarhus University, Denmark
2Department of Chemistry, Aarhus University, Denmark
3Department of Physiology and Biophysics, Aarhus University, Denmark
4Bioinformatics Research Centre, Aarhus University, Denmark - 5Centre for Membrane Pumps in Cells and Disease – PUMPKIN, Danish National Research Foundation, Aarhus University, Denmark
- 6Centre for Insoluble Protein Structures – inSPIN, Danish National Research Foundation, Aarhus University, Denmark
Link til animation
Mere information
Lektor Lea Thøgersen
Bioinformatics Research Centre og Molekylærbiologisk Institut, Aarhus Universitet
lea@birc.au.dk, mobil: 3026 1236
Ph.d.-studerende Maria Musgaard
Kemisk Institut, Aarhus Universitet
musgaard@chem.au.dk, mobil: 5190 5887
Professor Poul Nissen
Molekylærbiologisk Institut, Aarhus Universitet
pn@mb.au.dk, mobil: 2899 2295
Tekst: Lea Thøgersen, Poul Nissen og Lisbeth Heilesen
