Molekylært velcro hjælper med opbygningen af funktionelle kerneporekomplekser
Et internationalt hold forskere viser nu, hvordan en af de største molekylære maskiner - kerneporekomplekset - samles ved hjælp af såkaldte FG-polypeptider, der virker som molekylært velcro.
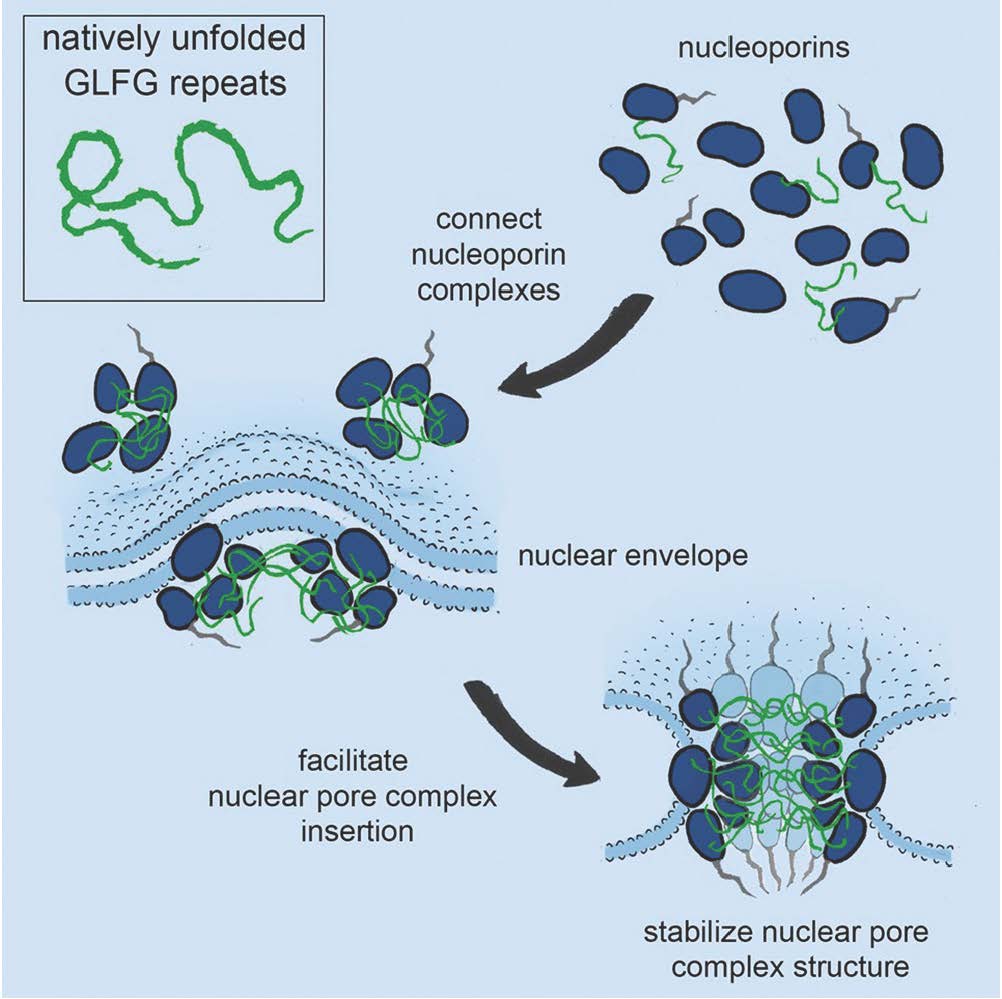
Kerneporekomplekset udgør en af de største og mest komplekse strukturer i vore celler. Poren udgør den eneste passage mellem kernen og cytoplasma og er dermed ansvarlig for al transport af makromolekyler (såsom RNA og proteiner) ind og ud af cellekernen. Kerneporekomplekset er sammensat af omkring 500 forskellige proteiner (nukleoporiner), som samles i funktionelle porer. Nogle nukleoporiner er strukturelle stilladsproteiner og andre danner den centrale hygrogel, der tillader selektiv transport. Denne hydrogel danner diffusionsbarrieren og er bygget af native ufoldede phenylalanine-glycine (FG)-rige polypeptider, som kun er gennemtrængelige for transport-receptorer, og som bringer andre makromolekyler igennem.
Forskerholdet fra USA, Schweiz og Danmark har for nyligt opdaget, at nogle nukleoporiner har strukturelle ligheder med transport-receptorer, og at de specifikt binder FG-polypeptider, men funktionen af disse interaktioner har indtil nu været et mysterium. I en ny videnskabelig artikel offentliggjort i tidsskriftet Cell, viser forskerne, at FG-polypeptiderne fungerer som molekylært velcro, som er vigtig for opbygningen af funktionelle kerneporekomplekser – et resultat som bringer os tættere på en forståelse af denne gigantiske molekylære maskine.
Thomas Schwartz fra MIT, der er en af seniorforfatterne på artiklen, besøger instituttet i begyndelsen af december og holder i den forbindelse en Kjeldgaard Lecture med titlen ”The machinery that enables nuclear communication” torsdag den 7. december 2017.
Mere information
Adjunkt Kasper Røjkjær Andersen
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
kra@mbg.au.dk
