Ny forskning viser, hvordan vigtigt protein holder vores cellemembraner i balance
I en omfattende undersøgelse offentliggjort i tidsskriftet Nature Communications har forskere studeret strukturen, funktionen og mekanismerne af proteinet ATP8B1, som spiller en vigtig rolle i regulering af galde i leveren. ATP8B1 har nu også vist sig som en genetisk markør for modstandsdygtighed over for Alzheimer's sygdom. Disse resultater åbner op for nye muligheder for behandling af forstyrrelser i balancen af galdesyre og neurodegenerative sygdomme.
Lipider er hovedbestanddelene i vores cellemembraner, der er dannet som lipid-dobbeltlag. Fordelingen af lipider er langt fra ensartet; den er asymmetrisk med forskellige lipidsammensætninger i de udvendige og indvendige lag. Denne asymmetri er afgørende for en række cellulære funktioner, fra at opretholde balancen i membranerne til at muliggøre cellesignalering og talrige andre fysiologiske processer i eller på tværs af membraner.
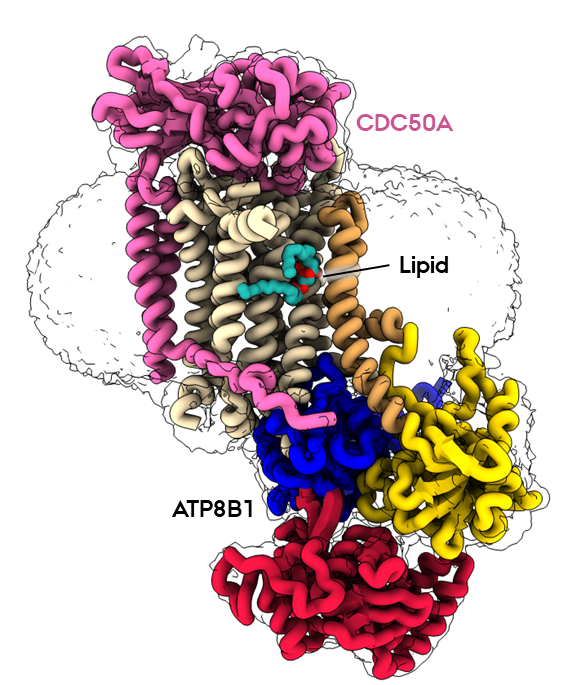
P4-ATPaser, også kendt som flippaser, er nøglespillere i skabelsen og opretholdelsen af denne lipidasymmetri. Disse enzymer transporterer aktivt lipider fra den udvendige (exoplasmatiske) side til den indvendige (cytosoliske) side af membranen, koblet til ATP-hydrolyse, og sikrer den korrekte fordeling af lipider. Især ATP8B1-CDC50A-flippasekomplekset har været genstand for den aktuelle undersøgelse, som har ført til flere nye, banebrydende opdagelser.
Funktionen af ATP8B1 lipid flippase er afgørende for reguleringen af galdeproduktionen, et vitalt stof i vores fordøjelsessystem, men det direkte link i galdeproducerende leverceller er stadig ukendt. Derudover har nylige studier fremhævet relevansen af genetiske varianter i det regulatoriske segment af ATP8B1-genet som en stærk genetisk markør for Alzheimers modstandsdygtighed. Interessant nok er mutationer, der forringer funktionen af den nært beslægtede ATP8B4 lipid flippase, modsat vigtige risikofaktorer for Alzheimers. Det er derfor af stor interesse at forstå, hvordan ATP8B1 er forbundet med disse processer og patologier.
I det nye studie har forskerholdet anvendt de mest avancerede kryo-elektronmikroskopiteknikker til at indfange ni forskellige tilstande forbundet med lipidtransporten og bestemme strukturer med en opløsning på 2,4 til 3,1 Å for disse tilstande. Disse strukturelle resultater, kombineret med funktionelle og beregningsmæssige studier, afslører den indre funktion i det humane flippase ATP8B1-CDC50A-kompleks og dets fine regulering af specifikke regulatoriske lipider kendt som fosfoinositider eller PIP'er.
Disse resultater åbner muligheder til en dybere forståelse af, hvordan lipidflippaser fungerer, og de komplicerede roller, de spiller i cellulære processer og reguleres. Som noget vigtigt, løser undersøgelsen også tidligere uoverensstemmelser om ATP8B1-transportsubstraterne.
Det er bemærkelsesværdigt, at både op- og nedregulering af ATP8B1-CDC50-funktionen potentielt kan være af interesse for lægemiddelforskning, og undersøgelsen giver da også vigtig information til sådanne anvendelser.
Holdet bag de nye resultater i Nature Communications er et samarbejde mellem forskere fra Aarhus Universitet (DANDRITE, Institut for Molekylærbiologi og Genetik og iNANO), Københavns Universitet, Oxford University og Université Paris-Saclay.
Den videnskabelige artikel er offentliggjort i det internationale tidsskrift Nature Communications.
Mere information
Professor Poul Nissen
Institut for Molekylærbiologi og Genetik & DANDRITE
Aarhus Universitet
Email: pn@mbg.au.dk. mobile: +4528992295
SUPPLERENDE OPLYSNINGER
Vi bestræber os på, at alle vores artikler lever op til Danske Universiteters principper for god forskningskommunikation. På den baggrund er artiklen suppleret med følgende oplysninger:
Studietype | Eksperiment |
Ekstern finansiering | This work was supported by a Marie Skłodowska-Curie Actions Individual Fellowship — 590 LivFlip (101024542) to T.D., by Engineering and Physical Sciences Research Council grants 591 (EP/X035603 and EP/V030779) to S. K., by an ANR grant (ANR-14-CE09-0022) to G.L., , made available under aCC-BY-NC-ND 4.0 International license. (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is bioRxiv preprint doi: doi.org/10.1101/2023.04.12.536557; this version posted May 4, 2023. The copyright holder for this preprint 20 592 by the French Infrastructure for Integrated Structural Biology (FRISBI; ANR-10-INSB-05) to 593 G.L., by the Centre National de la Recherche Scientifique (CNRS) to G.L., by the Lundbeck 594 Foundation to the BRAINSTRUC structural biology initiative (155-2015-2666) to K.L.-L. and 595 P.N., and by a Lundbeckfonden Professorship grant (R310-2018-3713) to P.N |
Interessekonflikt | Ingen |
Link til den videnskabelige artikel | Thibaud Dieudonné, Felix Kümmerer, Michelle Juknaviciute Laursen, Charlott Stock, Rasmus Kock Flygaard, Syma Khalid, Guillaume Lenoir, Joseph A. Lyons, Kresten Lindorff-Larsen and Poul Nissen. DANDRITE, Nordic EMBL Partnership for Molecular Medicine, Department of Molecular Biology and Genetics, Aarhus University, Aarhus, Denmark Structural Biology and NMR Laboratory & Linderstrøm-Lang Centre for Protein Science, Department of Biology, University of Copenhagen, Denmark Department of Biochemistry, University of Oxford, Oxford, United Kingdom Université Paris-Saclay, CEA, CNRS, Institute for Integrative Biology of the Cell (I2BC),91198, Gif-sur-Yvette, France Department of Molecular Biology and Genetics, Aarhus University, Aarhus, Denmark “Activation and substrate specificity of 1 the human P4-ATPase ATP8B1” Nature Communications |
