Ny indsigt i unik sukkertransport i planter
En lille forskningsgruppe på Aarhus Universitet har netop kortlagt strukturen af en vigtig sukkertransporter, der er unik for planter. Den nye struktur kan hjælpe med at forklare, hvordan planteorganer – såsom pollen – udvikler sig korrekt og give ideer til, hvorfor nogle underarter af hvede er resistente over for svampeangreb.
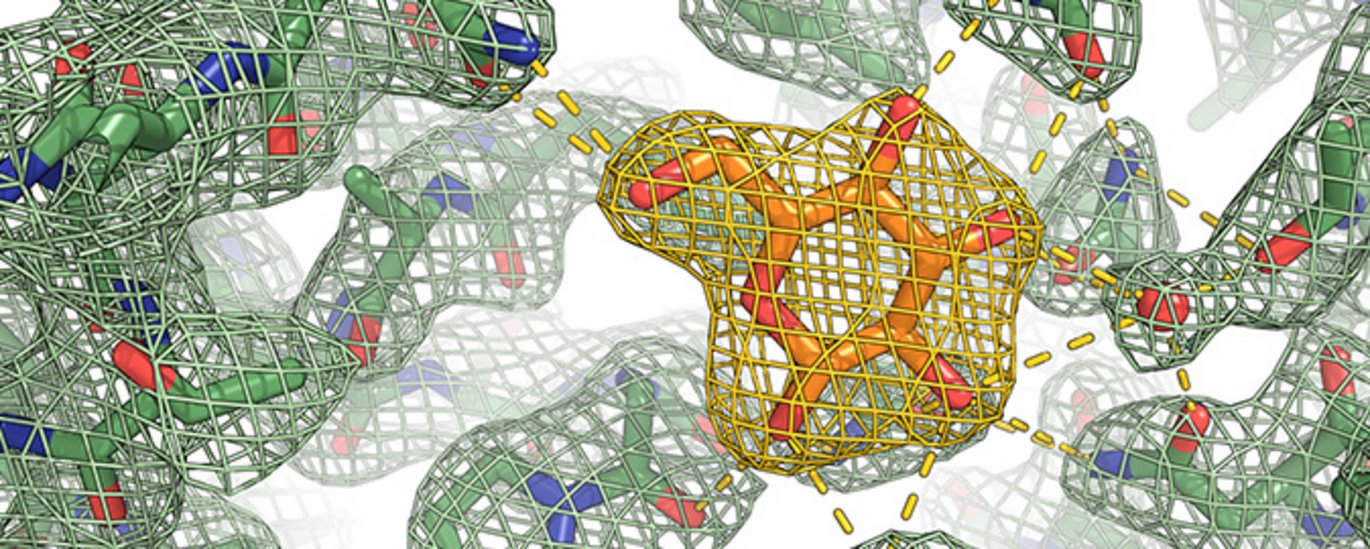
Sukkertransportproteiner
Sukkertransport gennem Sugar Transport Proteins (STP) er unik for planter, og er vigtig for korrekt udvikling af planteorganer, som f.eks. pollen. STP’er bruges også til at koncentrere sukker i specifikke væv såsom frugt, og de spiller en vigtig rolle i planternes forsvar mod svampeangreb fra f.eks. rust og meldug.
Sukker dannes i planteblade ved fotosyntese, og bliver transporteret som disakkaridet sukrose til andre dele af planten gennem sivævet. I rødder, pollen og frugter, kan planten optage sukkeret enten som sukrose eller, efter spaltning, som monosakkariderne glukose og fruktose.
Optag af glukose og andre monosakkarider bliver drevet af STP'er, der ved hjælp af en syre-gradient kan flytte sukker over den ellers uigennemtrængelige cellemembran. Disse proteiner har nogle særlige egenskaber sammenlignet med lignede proteiner fra dyr eller bakterier. De har en ekstremt høj affinitet for sukker; faktisk binder de 1000 gange kraftigere til sukker end lignende proteiner i mennesker. Samtidig bevarer de et meget højt aktivitetsniveau over et bredt pH-spektrum sammenlignet med andre syre-drevne sukkertransportere.
Første glimt af en unik transportmekanisme
Som de første i verden har en lille gruppe af forskere fra Institut for Molekylærbiologi og Genetik ved Aarhus Universitet løst en struktur af et STP sukkertransportprotein. Med dette resultat har forskerne været i stand til at give nye svar på, hvordan STP’er opnår deres særlige egenskaber.
STP’er er proteiner, der sidder i cellemembranen, og disse er meget vanskelige at arbejde med. Derfor tager det ofte mange år at opnå nye forskningsresultater, og det har det også gjort i dette tilfælde, hvor forskerne flere gange har måttet skifte strategi og anvende nye metoder.
”Det har været en ekstremt udfordrende proces. Undervejs har vi været nødt til at give slip på meget lovende resultater og starte forfra med nye metoder, fordi kvaliteten af dataene fra de traditionelle strukturelle metoder simpelthen ikke var god nok,” udtaler postdoc Peter Aasted Paulsen, der som førsteforfatter beskriver resultaterne i det prestigefylde tidsskrift Nature Communications. ”Det har været frustrerende at give slip på noget, der er næsten 'godt nok', for så at starte forfra fra en ny vinkel, men det har helt sikkert været nødvendigt. Man kan sige, at de mange små aha-oplevelser, vi har fået gennem i de mange forsøg, var det der i sidste ende løste problemerne med at få data af tilstrækkelig høj kvalitet. Det var fantastisk, da det endelig virkede!”
Et nyt domæne overrasker
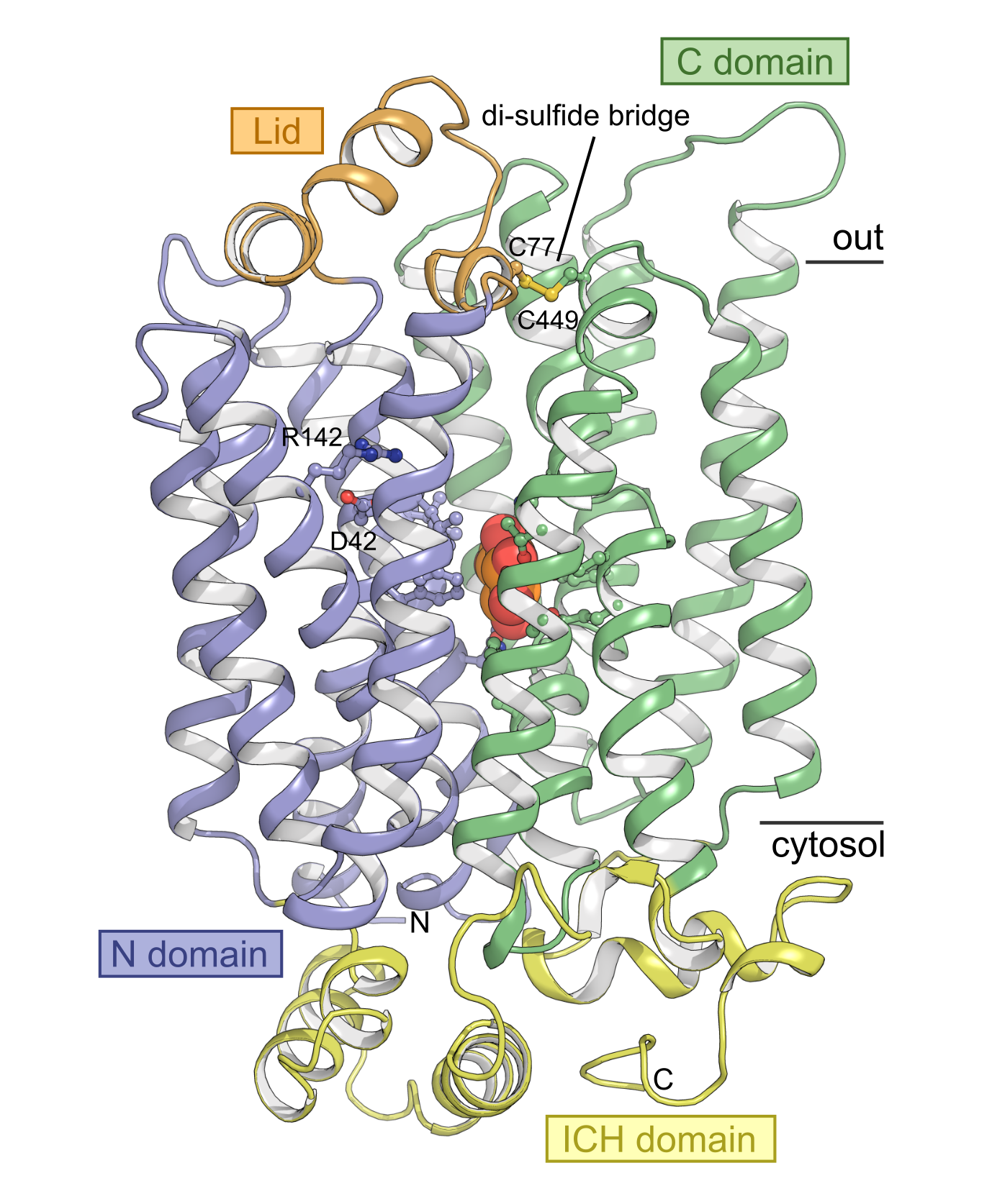
Med den nye struktur viser forskerne, at STP’erne i grove træk ligner andre sukkertransportere fra f.eks. mennesker. Men strukturen indeholder også overraskelser. Selv fremhæver Peter Aasted Paulsen et nyt domæne, der ikke er blevet beskrevet før. ”Over bindingslommen, hvor sukker placerer sig, har STP’erne et nyt lille domæne, der ligner et låg, som bliver holdt på plads med en usædvanlig binding, en såkaldt disulfidbro. Det var en helt uventet observation, som straks satte gang i fantasien.”
For at undersøge funktionen af domænet lavede forskerne en version af proteinet, hvor denne binding var fjernet. Med denne ændring mister proteinet sin evne til at transportere sukker effektivt ved visse pH-værdier. Sammenholder man disse resultater med en analyse af strukturen, kan man se, at låget holdes på plads ved hjælp af bindingen, hvorved den skaber et favorabelt miljø for syrebinding til en specifik proton bindingslomme. Denne binding får en del af proteinet til at blive skubbet mod sukkermolekylet, og dermed skabes den meget høje affinitet for sukker.
”Strukturel biologi kan noget helt særligt, når det kommer til at forklare de meget detaljerede mekanismer, der er i spil i de enkelte proteiner,” udtaler adjunkt Bjørn Panyella Pedersen, der er leder af forskergruppen, ”Jeg synes, det har været enormt tilfredsstillende at opleve, hvordan struktur og biokemi her har kunnet kombineres til at forklare noget helt fundamentalt om sukkertransport i planter, som vi ikke har vidst tidligere.”
Resultaterne kan gøre det lettere at udvikle resistente afgrøder
”Fra vores lidt nørdede synspunkt har det været enormt spændende at være med til at besvare de her meget fundamentale spørgsmål,” fortæller Bjørn Panyella Pedersen. ”Vi startede med at arbejde med de humane sukkertransportere, men da mange af de store spørgsmål inden for dette felt er blevet besvaret i løbet af de seneste par år, besluttede vi at vende vore fokus mod sukkeroptag i andre organismer.”
”STP’er kan noget helt særligt, og det er superspændende at være med til at forbedre vores forståelse af, hvordan de virker,” fortsætter Bjørn Panyella Pedersen, ”og det er specielt interessant, at de resultater, vi nu beskriver, er relaterede til, både hvordan mange af planers organer udvikler sig korrekt, og samtidig har vist sig at være relateret til planters forsvar mod svampeangreb. Der findes f.eks, nogle arter af hvede, der er svamperesistente, og vores resultater er med til at forklare, hvorfor de er det.”
Resultaterne er publiceret i Nature Communications:
Peter Aasted Paulsen, Tânia F. Custódio & Bjørn Panyella Pedersen:
Crystal structure of the plant symporter STP10 illuminates sugar uptake mechanism in monosaccharide transporter superfamily. https://doi.org/10.1038/s41467-018-08176-9.
Mere information
Adjunkt Bjørn Panyella Pedersen
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
bpp@mbg.au.dk – 2972 3499
Postdoc Peter Aasted Paulsen
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
peterap@mbg.au.dk
