Screening af proteiner kan bane vej for behandling af Parkinsons sygdom
Parkinsons sygdom er den mest almindelige neurodegenerative sygdom, og i øjeblikket er der ingen kur. Sammenhobning af proteinet ?-synuclein spiller en central rolle i denne sygdom. I samarbejde med et amerikansk lægemiddelsfirma har AU-forskere nu gennemført en ny screeningsstrategi, der har identificeret nye og strukturelt forskellige aggregeringshæmmere.

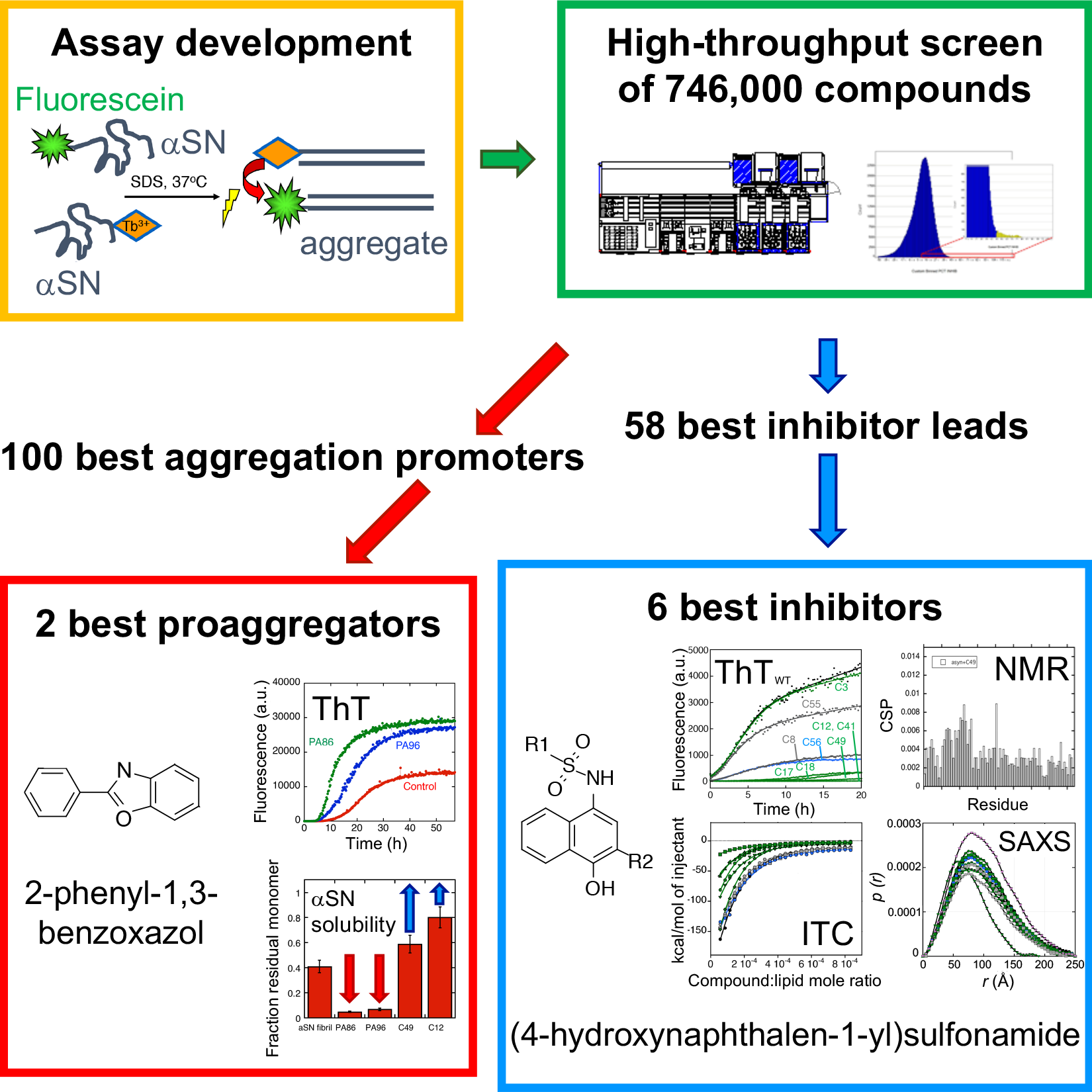
Parkinsons sygdom (PS) er den mest almindelige lidelse i verden hvor bevægelsesevnen påvirkes. PS-patienter lider af ufrivillig rystende bevægelse, langsom reaktionsevne samt gangbesvær. Der er tale om en neurodegenerativ sygdom, der skyldes dopaminmangel i neuroner i hjernen. I øjeblikket kan PS ikke helbredes eller standses i sin udvikling, men symptomer kan dog behandles i en vis grad. Den vigtigste årsag til sygdommen er aggregeringen af det udfoldede protein ?-synuclein (?SN). ?SN kan danne små oligomere komplekser (?SO'er) såvel som store fibrillære aflejringer, hvor ?SO'erne antages at være de mest skadelige arter. Hvis vi kan forhindre eller reducere ?SN aggregering, har vi en god måde at standse PS-udviklingen på. Hidtil har det været vanskeligt at scanne et stort antal forbindelser for at identificere potentielle aggregeringshæmmere, da ?SN aggregerer på en ret uregelmæssig og forskelligartet måde; det er også svært at opdage ?SO'er i deres tidlige stadie.
I den nye screeningsstrategi udviklede forskerne dog først et smart trick til at få ?SN’erne til at aggregere på en mere forudsigelig måde ved hjælp af "sæbe"-molekylet natriumdodecylsulfat. For at detektere aggregaterne anvendte de derefter Förster Resonance Energy Transfer (FRET); en udbredt teknik til måling af afstande indeni og mellem molekyler. På denne måde kunne de screene 746.000 forbindelser for deres evne til at inhibere ?SN aggregering.
Ved at gennemgå resultaterne kom de frem til en samling af strukturelt forskellige, små forbindelser, som enten hæmmer eller accelererer ?SN aggregering.
De seks bedste inhibitorer deler en fælles kernestruktur, og disse forbindelser interagerer alle sammen med den første del af ?SN, kaldet den N-terminale region.
Resultaterne er spændende på to måder: Først og fremmest kunne de identificerede hæmmende molekyler være et nyttigt udgangspunkt for at udvikle en behandling for PS-patienter. For det andet kan forbindelserne også bruges til at finde flere informationer om, hvordan ?SN-aggregering i cellen påvirker udviklingen af PS og dermed forstå mere om det molekylære grundlag for Parkinsons sygdom.
Disse resultater blev økonomisk støttet af innovationskonsortiet CureND fra Styrelsen for Videnskab, Teknologi og Innovation, forskningsrådene FNU, FTP og FSS, Danmarks Grundforskningsfond (Center for Excellence inSPIN) samt Aarhus Universitets forskningsfond.
Forskningen er udført af forskere fra Interdisciplinært Nanoscience Center (iNANO) og Institut for Molekylærbiologi og Genetik på Aarhus Universitet (AU) i samarbejde med Wyeth Research (nu en del af Pfizer). Professor Daniel Otzen har været ansvarlig for forskergruppen bag undersøgelsen.
Mere information
Professor Daniel Otzen
Interdisciplinary Nanoscience Center og Institut for Molekylærbiologi og Genetik
Aarhus Universitet
dao@inano.au.dk – 20725238
