Ny viden om proteiners dynamik kan forme fremtidens lægemiddeludvikling
Ny forskning giver mekanistisk indsigt i, hvordan proteindynamik styrer aktiviteten af en gruppe enzymer kaldet serinproteaser. Da serineproteaser spiller afgørende roller i blodkoagulationen, det medfødte immunsystem samt vævsombygning, kan resultaterne få betydning for udviklingen af nye lægemidler til behandling af forskellige sygdomme.
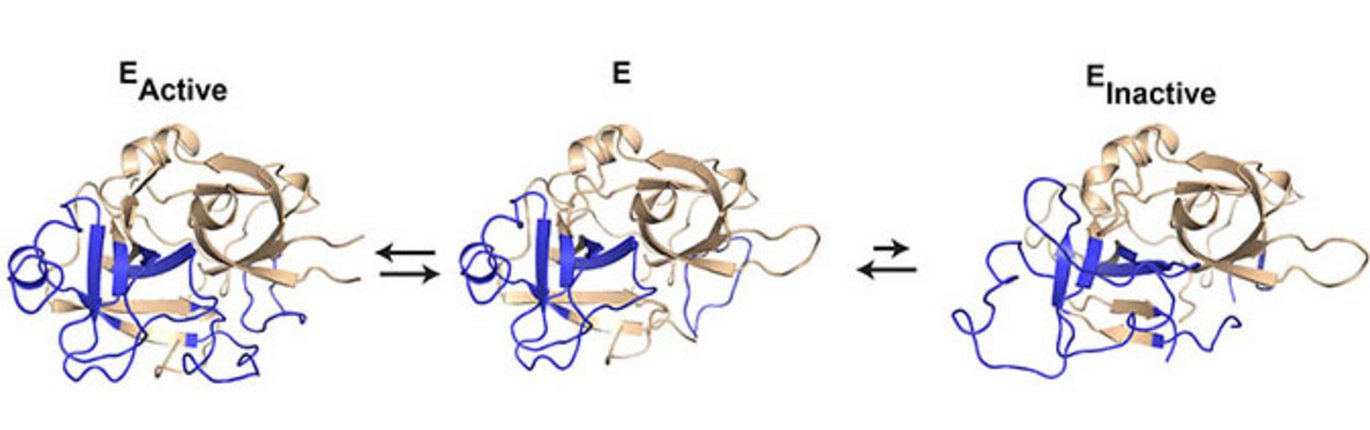
Proteiner regnes normalt for at have en stabil tredimensional struktur med en veldefineret foldning af peptidkæden. Meget tyder imidlertid på, at proteinernes peptidkæde undergår små eller store bevægelser, som konstant ændrer proteinets tredimensionelle struktur. Disse konstante ændringer i den tredimensionelle struktur kaldes proteindynamik. Selvom det længe har været kendt, at proteindynamik spiller en afgørende rolle for aktivitetsniveauet af en gruppe enzymer kaldet serinproteaser, har mekanismen bag disse observationer indtil nu været uvis. Da serinproteasers aktivitetsniveau spiller vigtige roller i blodkoagulationen, det medfødte immunsystem samt i vævsombygning bliver proteindynamikken dermed en afgørende faktor for kontrollen af disse livsvigtige fysiologiske processer.
De nye resultater, som netop er offentliggjort i det anerkendte tidsskrift Nature Scientific Reports, giver et mekanistisk indblik i den proteindynamik, som styrer aktivitetsniveauet i serinproteasen urokinase. Forskerene fra Aarhus Universitet løste fem forskellige krystalstrukturer af urokinase.
”Bestemmelsen af krystalstrukturerne var dog langt fra en nem opgave,” fortæller postdoc Tobias Kromann-Hansen. ”Urokinase er et super dynamisk protein som hele ændrer sin tredimensionelle struktur. Dette besværliggør dannelsen af krystaller,” fortsætter Tobias Kromann-Hansen. For at løse problemet udviklede forskerne fra Aarhus i samarbejde med forskere fra Vrije University Brussel og Leuven University kamelantistoffer, rettet mod urokinase.
”Kamelantistofferne har vist sig som et vigtigt værktøj inden for røntgenkrystallografi, idet de stabiliserer dynamiske proteiner og dermed muliggør dannelsen af krystaller,” fortæller Tobias Kromann-Hansen. Krystalstrukturerne gav forskerne fem forskellige snapshoots af urokinase og afslørede, at urokinases peptidekæde undergår overraskende store bevægelser, hvilket dermed bestemmer, om serinproteasen er i en aktiv eller inaktiv tilstand. Disse bevægelser blev yderligere kortlagt under anvendelse af en særlig teknik, HDX-MS (hydrogen-deuterium exchange monitored by mass spectrometry), som professor Elizabeth A. Komives, University of California San Diego er verdens førende ekspert i. Sammenholdt med biokemiske studier gav krystalstrukturerne og HDX-MS resultaterne en detaljeret beskrivelse af de molekylære mekanismer, som ligger til grund for den proteindynamik, som styrer urokinases aktivitetsniveau.
Resultaterne giver en bedre grundvidenskabelig forståelse for, hvorledes serinproteaser fungerer. Men forskerne håber at resultaterne kan åbne op for nye muligheder for sygdomsbehandling. Tobias Kromann-Hansen forklarer: ”Med disse resultater har vi set, at urokinase kan eksistere i en ligevægt mellem en aktiv og en inaktiv tilstand. Vi kender nu formen på den inaktive tilstand. Ved at udvikle molekyler som specifikt genkender og stabiliserer den inaktive tilstand, kan vi muligvis forskyde denne ligevægt for dermed at hæmme den sygdomsfremmende aktivitet af urokinase i fx cancer og gigt. Vores håb er at finde tilsvarende inaktive tilstande i andre serinproteaser og dermed anvende dette princip til at behandle andre alvorlige sygdomme”.
Forskningen har været mulig pga. støtte fra Carlsbergfonden gennem projektmidler til Tobias Kromann-Hansens ophold som postdoc ved University of California San Diego, samt projektmidler fra Danish-Chinese Centre for Proteases and Cancer, ledet af nu afdøde Peter A. Andreasen fra Institut for Molekylær Biologi og Genetik på Aarhus Universitet.
Link til den videnskabelige artikel i Nature Scientific Reports
Mere information
Postdoc Tobias Kromann-Hansen
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
og the Department of Chemistry and Biochemistry
University of California San Diego, USA
Nu: Afd. For Biokemi og Immunologi
Vejle/Kolding Sygehus
Tobias.Kromann-Tofting@rsyd.dk; 24452009
