Proteinkompleks fungerer som skytsenzym imod skadelige biprodukter i cellerne
Danske og tyske forskere har ved fælles indsats karakteriseret en cellulær aktivitet, der beskytter vores celler imod nogle af genekspressionens potentielt skadelige biprodukter. Denne aktivitet er muligvis afgørende for flercellede organismers evne til at opretholde et robust ’evolutionsreservoir’ af RNA.
Enhver fremstillingsproces er til en vis grad fejlbehæftet og kræver kvalitetskontrol og effektiv affaldshåndtering for at sikre, at det endelige produkt er fuldt funktionelt, og at ophobede biprodukter bortskaffes eller genbruges på forsvarlig vis. Dette gælder også i forbindelse med transskriptionen af vores genom, som er en ufuldkommen proces, der fører til dannelse af store mængder af ikke-funktionelt og potentielt skadeligt RNA.
RNA polymerase II enzymet er den mest alsidige RNA polymerase i menneskeceller, og dette enzym er ansvarlig for transskriptionen af størstedelen af vores gener samt et stort antal genomiske områder, hvor der ikke findes gener i konventionel forstand. Over det seneste årti er det således blevet klart, at RNA polymerase II kan påbegynde transskriptionen fra et væld af områder i genomet, hvoraf en stor del ikke svarer til et rigtigt gen og derfor ikke fører til produktion af funktionelt RNA. Sidstnævnte sker kun, når der også forefindes specifikke ’gen-definerende’ sekvenser.
Nyopdaget aktivitet af proteinkomplekset 'Integrator'
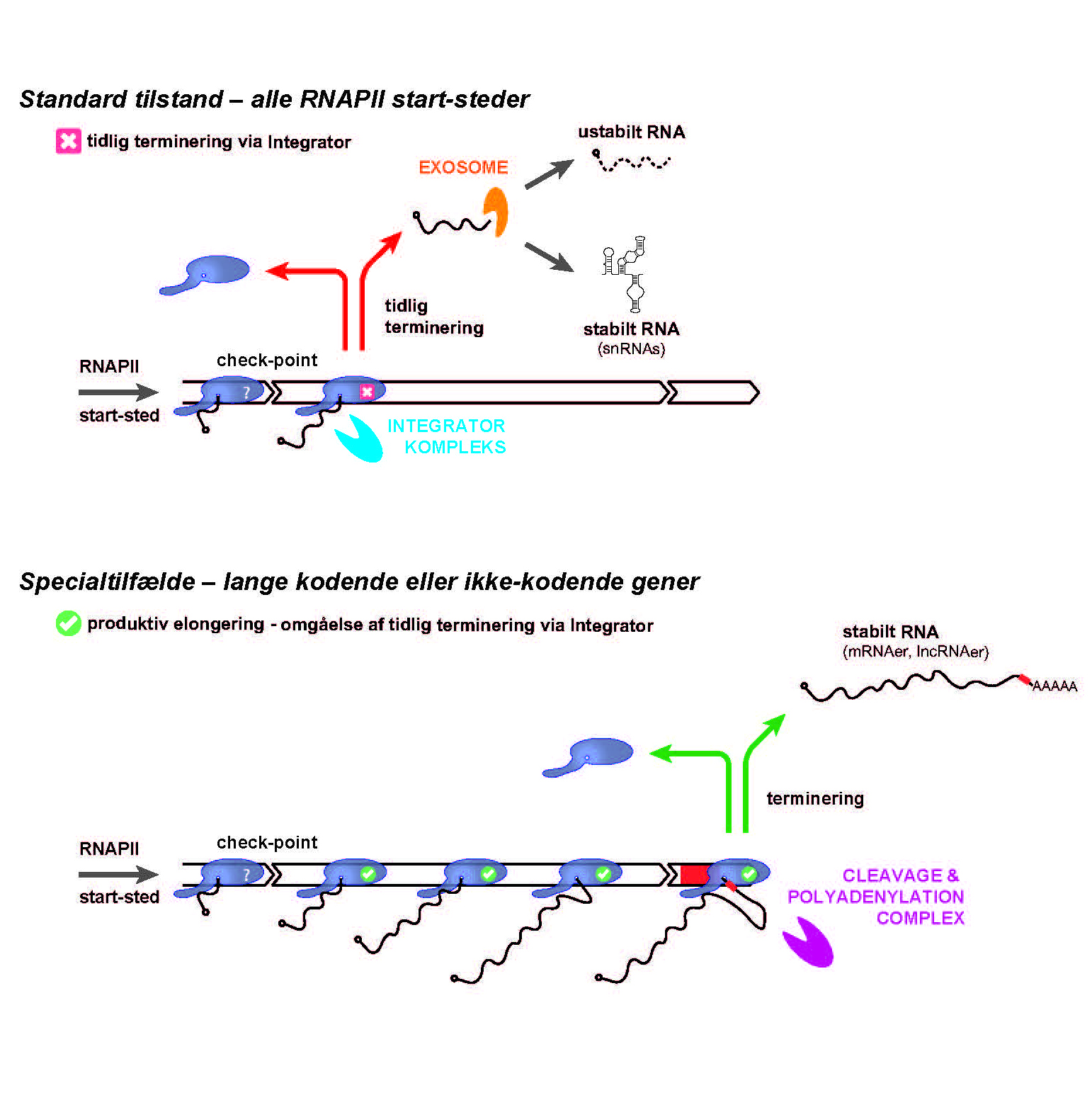
Et dansk-tysk forskningssamarbejde har i en ny artikel – udgivet i det internationale tidsskrift Molecular Cell – påvist, at proteinkomplekset Integrator i udgangspunktet afslutter enhver RNA polymerase II transskriptionshændelse umiddelbart efter, at denne er påbegyndt (figur, øverste panel). Dermed tilføjes væsentlig viden til forståelsen af Integrators funktion, der i forvejen var kendt for at afslutte transskriptionen af en bestemt klasse af gener, der koder for såkaldte ’small nuclear’ (sn)RNAer.
De korte transskripter, der er dannet af Integrator, bliver som oftest tilintetgjort af RNA nedbrydningsenzymet ’RNA exosome’. Den beskrevne mekanisme er i spil i varierende grad ved begyndelsen af konventionelle gener, men disse har udviklet sekvens-elementer, der modvirker denne tidlige afslutning og i stedet faciliterer en omstilling af RNA polymerase II til produktiv transskriptions-elongering. Dette fører til dannelsen af funktionelle ’lange’ transskripter såsom protein-kodende ’messenger’ (m)RNAer (figur, nederste panel).
Den nyopdagede aktivitet af Integrator sikrer, at ødsel transskription holdes på et lavt niveau, mens tusindevis af transskriptionelt aktive områder i menneskegenomet samtidig vedligeholdes under neutral evolutionær selektion. Disse områder udgør et reservoir af transskriptionsenheder, der på sigt kan blive omdannet til egentlige funktionelle gener. Denne mekanisme ligger formodentlig til grund for dannelsen af lang række af de gener, der på nuværende tidspunkt producerer funktionelle RNA i vores celler. De tidligere nævnte snRNA gener synes at udgøre et særtilfælde, da disse udnytter Integrators tidlige transskriptionsafslutning, men kan modstå RNA exosomet og derved danne stabile funktionelle RNAer (figur, øverste panel).
Inaktiverende mutationer i Integrator-komplekset kan medføre alvorlige neurologiske lidelser, og derudover er forøget Integrator-aktivitet forbundet med metastase-spredning i forbindelse med kræftsygdomme. Derfor skal aktiviteten af Integrator være under streng kontrol i normale celler. Opdagelsen af, at Integrator-kompleksets aktivitet er allestedsnærværende i genomet og tjener til at afslutte ikke-produktiv transskription, kan således bidrage til at klarlægge de molekylære mekanismer bag de nævnte sygdomme.
Projektet blev udført som et samarbejde mellem forskere fra Max Planck Instituttet i Göttingen og Aarhus Universitet.
Den videnskabelige artikel er udgivet i det internationale tidsskrift Molecular Cell:
Søren Lykke-Andersen, Kristina Žumer, Ewa Šmidová Molska, Jérôme O. Rouvière, Guifen Wu, Carina Demel, Björn Schwalb, Manfred Schmid, Patrick Cramer and Torben Heick Jensen
“Integrator is a genome-wide attenuator of nonproductive transcription”
DOI: https://doi.org/10.1016/j.molcel.2020.12.014
Mere information
Søren Lykke-Andersen, PhD - sla@mbg.au.dk – mobil: +45 50510996
Professor Torben Heick Jensen - thj@mbg.au.dk – mobil: +45 60202705
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
