Røntgenstråler skyder hul i bakteriers selvforsvar
En gruppe forskere fra Aarhus Universitet har fået et unikt indblik i, hvordan bakterier styrer mængden af giftstoffer i cellen. De nye resultater vil på sigt muliggøre nye former for behandling af bakterielle infektioner.
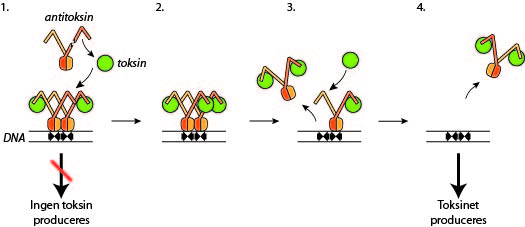
Mange sygdomsfremkaldende bakterier er i stand til at gå i dvale ved at danne såkaldte ”persister”-celler, der ikke er modtagelige over for almindelige antibiotika. Dette er et alvorligt problem i behandlingen af livstruende sygdomme som fx tuberkulose, hvor tilstedeværelsen af persister-celler betyder, at sygdommen ofte blusser op igen efter endt medicinsk behandling.
Dannelsen af persister-celler skyldes på det molekylære plan tilstedeværelsen af giftstoffer (toksiner), som bakterierne selv producerer, og som sætter dem i stand til at overgå til en dvaletilstand. I dvaletilstanden regulerer bakterierne hele tiden mængden af toksin, så den holder sig på præcis samme niveau og dermed fastholder tilstanden af dvale.
I en artikel netop publiceret i det amerikanske videnskabelige tidsskrift Structure, præsenterer forskere ved Institut for Molekylærbiologi og Genetik ved Aarhus Universitet helt nye resultater, der afdækker detaljerne i toksinernes reguleringsmekanisme.
Forskerholdet, bestående af de to ph.d.-studerende Andreas Bøggild og Nicholas Sofos samt lektor Ditlev E. Brodersen, har ved at isolere og krystallisere toksin-molekylerne og deres molekylære følgesvende, anti-toksinerne – og ved efterfølgende at udsætte krystallerne for kraftig røntgenstråling – fået et unikt indblik i, hvordan bakterierne styrer mængden af toksin i cellen (illustreret i infoboksen).
De nye resultater vil på sigt muliggøre nye former for behandling af bakterielle infektioner, hvor blokering af toksinernes funktion og produktion kombineres med traditionelle antibiotika til at bekæmpe sygdomsbakterierne.
Link til artiklen i Structure: The crystal structure of the intact E coli RelBE toxin-antitoxin complex provides the structural basis for conditional cooperativity
Andreas Bøggild,1,3 Nicholas Sofos,1,3 Kasper R. Andersen,1,4 Ane Feddersen,1 Ashley D. Easter,2 Lori A. Passmore,2 and Ditlev E. Brodersen1
1Centre for mRNP Biogenesis and Metabolism, Department of Molecular Biology and Genetics, Aarhus University, DK-8000 Aarhus C, Denmark
2MRC Laboratory for Molecular Biology, Cambridge CB2 0QH, UK
3These authors contributed equally to this work
4Present address: Department of Biology, Massachusetts Institute of Technology, Cambridge, MA 02139, USA
Mere information
Lektor Ditlev E. Brodersen
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
deb@mb.au.dk - +45 21669001
Tekst: Ditlev E. Brodersen og Lisbeth Heilesen
