Strukturel viden om DNA reparationskomplekset
Ny dansk forskning giver mekanistisk indsigt i, hvordan vores DNA bliver overvåget og repareret, når der sker skader. Resultaterne kan på sigt bidrage til at forbedre behandlingen af visse kræfttyper, da DNA reparationskomplekset bidrager til, at visse kræftceller kan modstå kemoterapi.
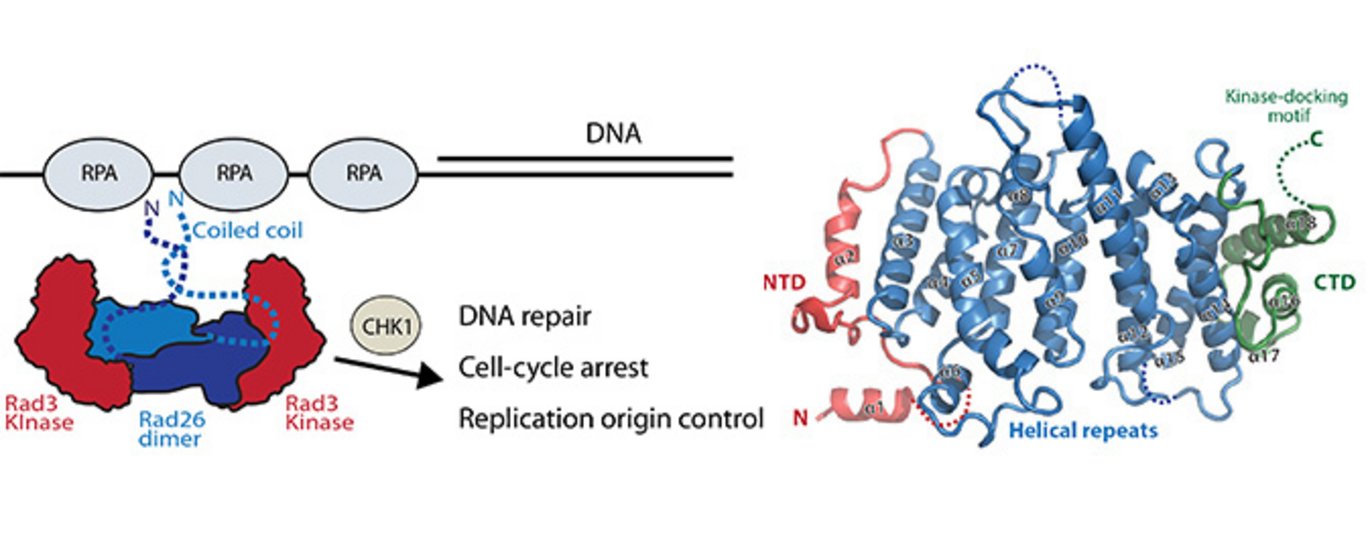
Vores DNA bliver konstant udsat for skader, og for at beskytte genomet er der udviklet mekanismer, som overvåger og reparerer disse skader. Vores strukturelle viden om det proteinkompleks, som overvåger DNA’et har indtil nu været begrænset. Ny forskning beskriver nu strukturen og organiseringen af DNA kontrolproteinet Rad26 og viser, hvordan kinasen Rad3 bliver rekrutteret til et skadet DNA.
For at vedligeholde genomet skal de skader, der sker på DNA’et findes og repareres. Første trin i denne proces bliver orkestreret af Rad3 kinasen. Rad26 er en funktionel subunit af Rad3-Rad26 DNA reparationskomplekset og er ansvarlig for at bringe kinasen til steder med DNA-skader, men mekanismen bag kinase-rekruttering og strukturel viden om, hvordan dette komplet er organiseret, har indtil nu været uvis.
Nye resultater fra Aarhus afslører krystalstrukturen af Rad26 og identificerer de elementer, der er vigtige for at rekruttere Rad3 kinase. Rad26 er en dimer med et konserveret interface i den N-terminale del af proteinet. Biokemiske data viste, at Rad26 bruger sit C-terminale domæne og et konserveret motiv til at rekruttere Rad3. Ud fra det in vitro rekonstituerede Rad3-Rad26 kompleks, small-angle X-ray scattering og elektronmikroskopiske studier er det muligt at modellere den kvarternære struktur og dermed bringe os nærmere en mekanistisk forståelse af Rad3-Rad26 DNA reparationsapparatet.
Rad3 signalering har til opgave at sikre, at celler ikke deler sig, inden DNA skader er repareret, og Rad3 giver dermed kræftceller en mekanisme til at modstå kemoterapi ved at reparere disse DNA skader. Vores nye strukturelle viden vil hjælpe udviklingen af Rad3 inhibitorer, som gør kræftceller mere modtagelige for kemoterapi, og denne nye behandlingsform bliver nu afprøvet i kliniske forsøg.
Link til den videnskabelige artikel publiceret i The Journal of Biological Chemistry.
Mere information
Adjunkt Kasper Røjkjær Andersen
kra@mbg.au.dk - 87154928
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
