Strukturen af proteinet ATP8B1 afslører vigtige reguleringsmekanismer
Proteinet ATP8B1 er afgørende for korrekt udskillelse af galdesyre i leveren, og mutationer af ATP8B1 er forbundet med alvorlige leversygdomme. Funktionelle studier og bestemmelsen af den tredimensionelle struktur af proteinet afslører nu, at ATP8B1 aktivitet er reguleret gennem dets N- og C-terminale segmenter og af såkaldte fosfoinositide lipider. Resultaterne bidrager til forståelsen af, hvordan aktiviteten af ATP8B1 reguleres og kan åbne op for nye muligheder for udvikling af lægemidler.
Progressiv familiær intrahepatisk kolestase (PFIC) er en sjælden, arvelig leversygdom, der skyldes nedsat galdeproduktion eller -flow. Dette forårsager leverskade, og i alvorlige tilfælde kan PFIC medføre leversvigt og død før voksenalderen.
Type 1 PFIC er forårsaget af mutationer af det humane ATP8B1. Dette protein er medlem af P4-ATPase familien, også kendt som lipid flippaser, der transporterer fosfolipider over den cellulære membran. ATP8B1s funktion som en lipid flippase bidrager bl.a. til reguleringen af lipidfordelingen af den del af levercellers membran der danner væggen af den kanal hvor galdesyre bliver transporteret fra levercellerne og videre ud i systemet. Regulering af lipidfordelingen kan gøre at cellerne bedre kan modstå galdesyren. ATP8B1 findes også i mange andre væv, såsom hjertet og hjernen, og en genom-omfattende associationsundersøgelse har vist, at regulering af ATP8B1-ekspression er en stærk faktor i modstandsdygtigheden over for Alzheimers sygdom.
Forskere fra University of Paris-Saclay, Ruhr University Bochum og Aarhus Universitet har via et samarbejde udforsket strukturen, funktionen og reguleringen af ATP8B1-CDC50A komplekset. Fuldlængde ATP8B1 viste sig at være inaktiv men afkortningen af den C-terminale region af ATP8B1 resulterede imidlertid i aktivering af kompleksets ATPase-aktivitet. Denne aktivitet blev yderligere øget, af at den N-terminale region af ATP8B1 også blev afkortet, altså er der tale om en indbygget hæmningsmekanisme også kaldet autoinhibering. Aktivitetsassays af den terminalt afkortede ATP8B1 afslørede yderligere, at fosfoinositider er nødvendige som co-faktor for at fremkalde transporten af fosfolipider.
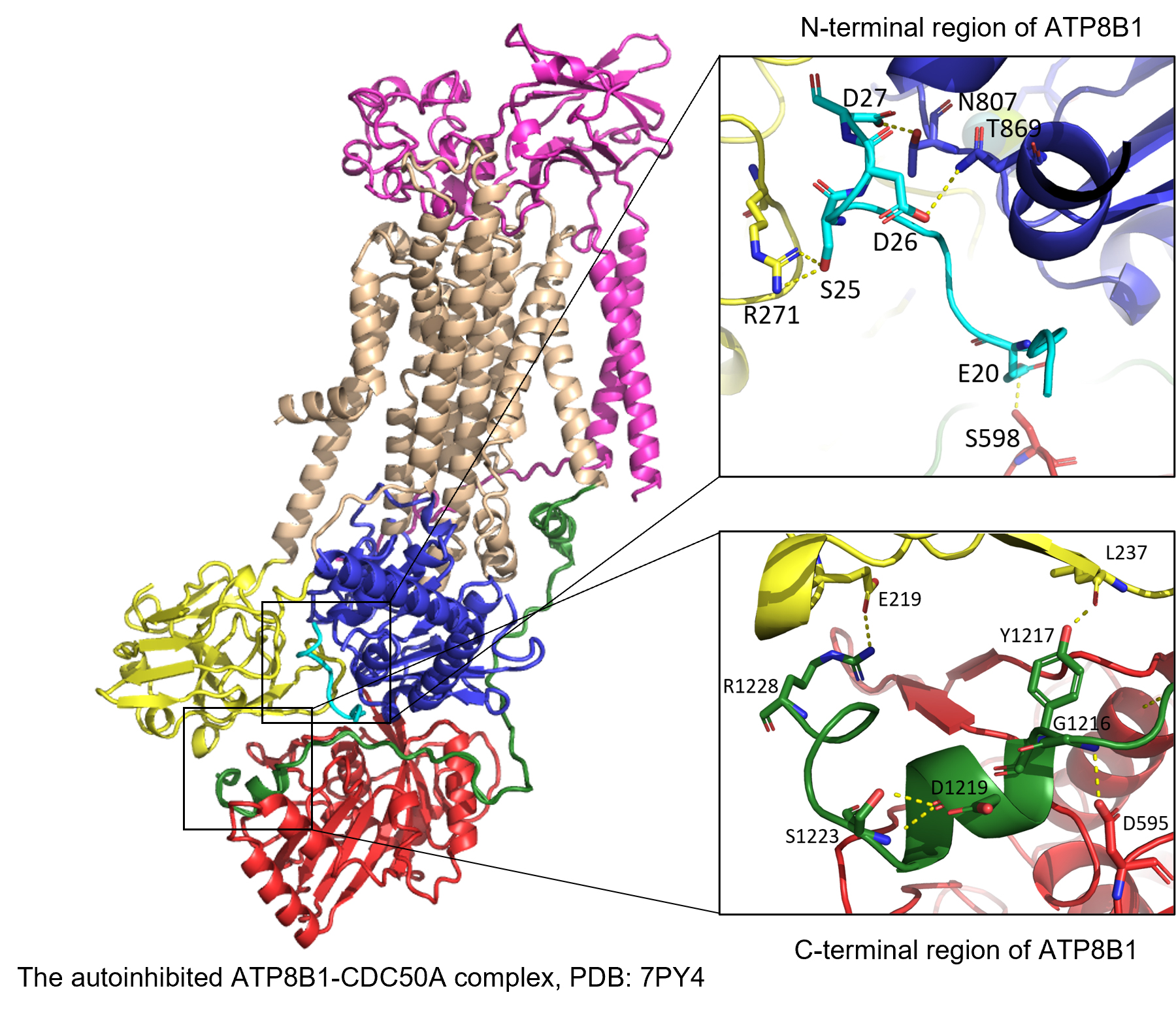
Ved hjælp af Cryo-EM blev strukturen af den autoinhiberede ATP8B1 i kompleks med CDC50A bestemt til en overordnet opløsning på 3,1 Å. ATP8B1 har en P-type ATPase-topologi med et transmembrant domæne (vist i hvede) og tre intracellulære domæner kendt som P-, N- og A-domænet (vist med henholdsvis blåt, rødt og gult). Et vigtigt aspekt er, at strukturen afslørede, at både den N- og C-terminale region hver binder til alle tre intracellulære domæner på en måde, der forhindrer en konformationel overgang forbundet med transportcyklussen. Endvidere er en aminosyre lokaliseret i den C-terminale region, Ser-1223, involveret i tætte interaktioner og har vist sig at være fosforyleret i en fosfoproteomisk undersøgelse i mus. Ser-1223 er bevaret i human ATP8B1.
På grund af Ser-1223's tætte interaktioner var det forventet at fosforylering på dette sted ville påvirke bindingsegenskaberne og hæmningen af den C-terminale region. For yderligere at udforske effekten af fosforyleringen blev den afkortede ATP8B1 behandlet med peptider svarende til den manglende C-terminale region med og uden en fosforylering ved Ser-1223. Faktisk reducerede fosforylering hæmningen 25 gange, hvilket indikerer, at fosforylering af Ser-1223 kan være en del af den mekanisme, der fremmer frigivelsen af den autoinhiberende C-terminus og dermed aktiveringen af ATP8B1.
De nye resultater om regulatoriske mekanismer af ATP8B1 tyder på, at molekyler, der enten efterligner den hæmmende effekt af den C-terminale region eller frigiver den hæmmende C-terminale region, kunne regulere ATP8B1 aktivitet og kan åbne for ny brug af nye lægemidler til f.eks. leversygdomme og Alzheimers sygdom.
SUPPLERENDE OPLYSNINGER, HERUNDER KONTAKTOPLYSNINGER
Vi bestræber os på, at alle vores artikler lever op til Danske Universiteters principper for god forskningskommunikation. På den baggrund er artiklen suppleret med følgende oplysninger:
PUNKTER | INDHOLD OG FORMÅL |
Studietype | Eksperiment |
Ekstern finansiering | EMBO (Short-term fellowship 7881): Thibaud Dieudonné French Infrastructure for Integrated Structural Biology (FRISBI ANR-10-INSB-05): Christine Jaxel, Cédric Montigny, Guillaume Lenoir French Ministry for Higher Education (PhD fellowship): Thibaud Dieudonné European Commission (Marie Sklodowska-Curie individual fellowship): Thibaud Dieudonné Agence Nationale de la Recherche (Young Investigator grant ANR-14-CE09-0022): Guillaume Lenoir Lundbeckfonden (Professorship grant): Poul Nissen Deutsche Forschungsgemeinschaft (GU 1133/11-1): Thomas Günter Pomorski Dansih Agency for Science and Higher Education (5072-00025B – Danish National Cryo-EM Research Infrastructure (EMBION)): Poul Nissen The funders had no role in study design, data collection and interpretation, or the decision to submit the work for publication. |
Interessekonflikt | Forskerne erklærer at der ingen interessekonflikt er. |
Link til videnskabelig artikel | Autoinhibition and regulation by phosphoinositides of ATP8B1, a human lipid flippase associated with intrahepatic cholestatic disorders
Thibaud Dieudonné, Sara Abad Herrera, Michelle Juknaviciute Laursen, Maylis Lejeun, Charlott Stock, Kahina Slimani, Christine Jaxel, Joseph A Lyons, Cédric Montigny, Thomas Günther Pomorski, Poul Nissen, Gillaume Lenoir eLife 11:e75727 https://doi.org/10.7554/eLife.75272
|
Kontaktdata | Professor Poul Nissen |
