Tæt samarbejde mellem RNA-nedbrydnings- og kromatin-regulerende komplekser holder transposable RNA'er under kontrol
Pattedyrs genomer er blevet koloniseret af såkaldt transposable elementer (TE'er), 'genetiske parasitter' som optager ~50% af genomisk DNA og rummer formeringspotentiale og dermed genetisk ustabilitet. Disse elementer er derfor udsat for stram cellulær kontrol. Mens vores forståelse af TE-regulering har været domineret af transskriptionelle og epigenetiske modeller, har rollen af post-transskriptionel RNA-nedbrydning ikke være udforsket.
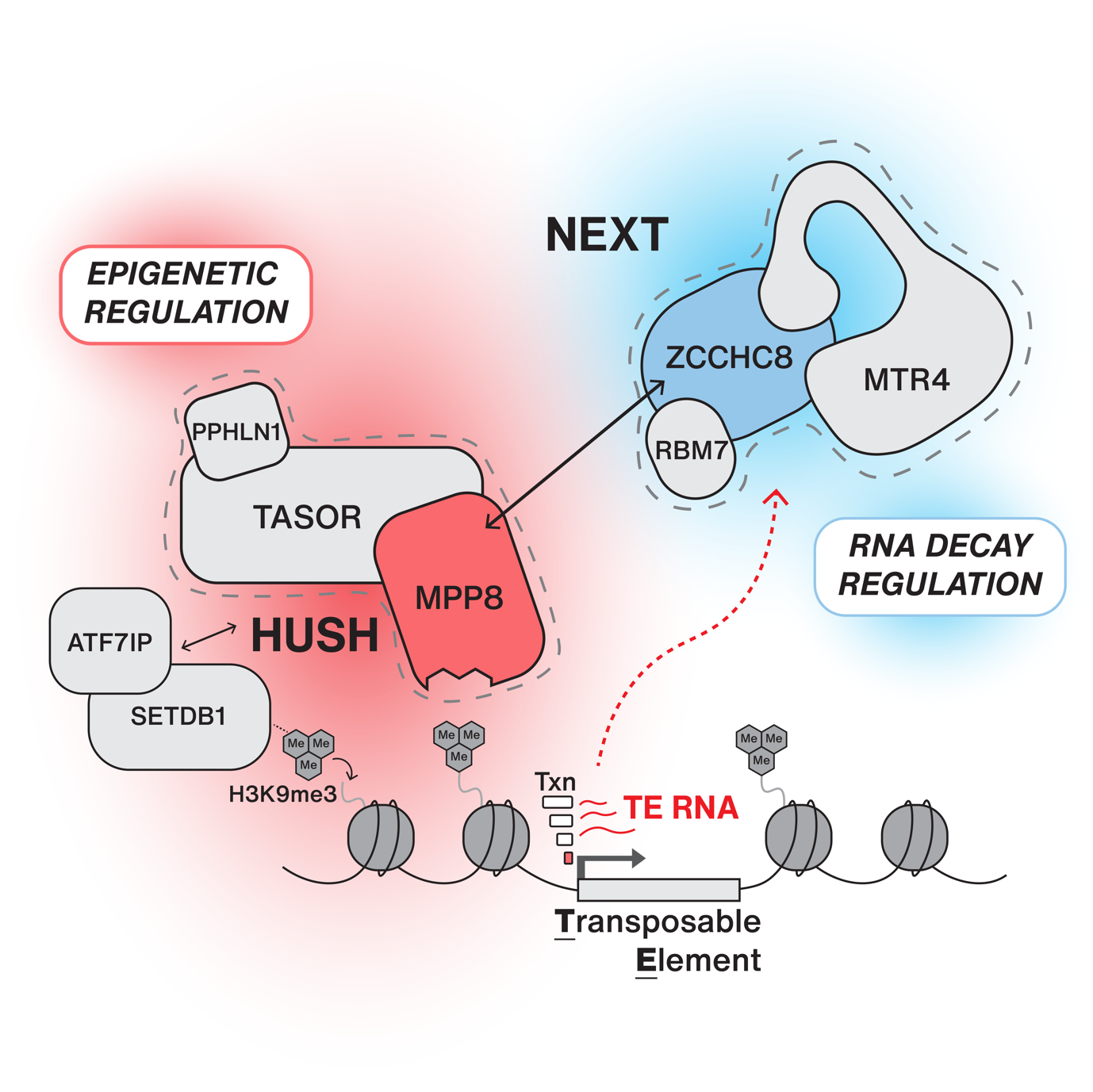
Nu har et dansk forskerhold imidlertid identificeret en forbindelse mellem "nuclear exosome targeting" (NEXT) og "human silencing hub" (HUSH)-komplekserne, involveret i henholdsvis nuklear RNA-nedbrydning og epigenetisk silencing af TE'er. Forskerne viser, at NEXT globalt undertrykker TE RNA-niveauer i museembryonale stamceller (ES), hvilket bliver tilvejebragt af en rekruttering til TE loci via HUSH-komplekset. Dette afslører en hidtil ukendt samarbejdsmekanisme for transskriptionel og post-transskriptionel kontrol i begrænsning af den genotoksiske aktivitet af TE RNA'er.
Torben Heick Jensens forskergruppe har tidligere identificeret og karakteriseret NEXT-komplekset, der målretter ikke-adenylerede (pA-) RNA'er til det nukleare exosomkompleks med henblik på nedbrydning. For at undersøge om NEXT spiller en rolle i TE RNA kontrol, blev NEXT proteinet, ZCCHC8, ”knocked out” (KO) i ES-celler ved hjælp af CRISPR/Cas9, og disse celler blev high-throughput RNA-sekventeret med speciel fokus på TE RNA. Interessant nok blev TE RNA'er kraftigt stabiliserede efter NEXT KO-behandling.
Forskergruppen kunne yderligere vise, at NEXT fysisk interagerer med HUSH, og at denne forbindelse målretter rekruttering af NEXT til DNA for at nedbryde pA- TE-RNA'er, mens HUSH har til formål at regulere pA+ TE-RNA'er. Denne sammensatte mekanisme sikrer nu, at TE RNA-mængden begrænses.
Resultaterne er blevet til via et samarbejde mellem forskningsgrupperne ved Torben Heick Jensen ved Institut for Molekylærbiologi og Genetik, Aarhus Universitet, Kristian Helin ved Center for Epigenetik, Memorial Sloan Kettering Cancer Center og Albin Sandelin ved Biotech Research and Innovation Center (BRIC), Københavns Universitet. Studierne blev ledet af postdoc Will Garland fra Aarhus Universitet.
Resultaterne er offentliggjort I det internationalt anerkendte tidsskrift Molecular Cell.
Chromatin modifier HUSH co-operates with RNA decay factor NEXT to restrict transposable element expression. William Garland, Iris Müller, Mengjun Wu, Manfred Schmid, Katsutoshi Imamura, Leonor Rib, Albin Sandelin, Kristian Helin and Torben Heick Jensen. Molecular Cell (2022) doi:10.1016/j.molcel.2022.03.004.
Mere information
Adjunkt Will Garland - garland@mbg.au.dk
Professor Torben Heick Jensen - thj@mbg.au.dk
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
Supplerende oplysninger
Vi bestræber os på, at alle vores artikler lever op til Danske Universitetersprincipper for god forskningskommunikation. På den baggrund er artiklen suppleret med følgende oplysninger:
Studietype: Eksperiment
Eksterne samarbejdspartnere:
Kristian Helin ved Center for Epigenetik, Memorial Sloan Kettering Cancer Center og Albin Sandelin ved Biotech Reearch and Innovation Center (BRIC), Københavns Universitet.
Finansiering:
Arbejdet blev støttet med finansiering fra:
T.H.J. laboratorium blev støttet af Danmarks Forskningsfond, Lundbeckfonden og Novo Nordisk Fonden (NNF). Arbejdet i K.H. laboratorium blev støttet af et tilskud til NNF Center for Stem Cell Biology (NNF17CC0027852) og gennem Memorial Sloan Kettering Cancer Center Support Grant (NIH P30 CA008748). Arbejder i A.S. laboratorium blev støttet af bevillinger fra NNF og Lundbeckfonden.
Interessekonflikter:
K.H. er medstifter af Dania Therapeutics, konsulent for Inthera Bioscience AG og videnskabelig rådgiver for MetaboMed Inc. og Hannibal Innovation.
Link til den videnskabelige artikel:
Chromatin modifier HUSH co-operates with RNA decay factor NEXT to restrict transposable element expression. William Garland, Iris Müller, Mengjun Wu, Manfred Schmid, Katsutoshi Imamura, Leonor Rib, Albin Sandelin, Kristian Helin and Torben Heick Jensen. Molecular Cell (2022) doi:10.1016/j.molcel.2022.03.004.
Kontakt:
Adjunkt Will Garland - garland@mbg.au.dk
Professor Torben Heick Jensen - thj@mbg.au.dk
Institut for Molekylærbiologi og Genetik, Aarhus Universitet
