Velkendt proteins dobbeltrolle kaster lys over mekanismerne bag Parkinsons sygdom
I årevis har klumpdannelser af alfa-synuclein-proteinet (aSN) været kendt som en central spiller i sygdomme, der nedbryder hjernen og dens funktioner. Funktionen af naturligt, opløseligt aSN har imidlertid været ukendt. Men ny forskning fra Aarhus Universitet med internationale samarbejder har afsløret, at naturlig aSN aktiverer en vigtig calciumpumpe i cellemembranen. Regulering af calciumsignaler forstyrres dermed af sammenklumpningen af aSN. Denne opdagelse er et vigtigt skridt i retning af at forstå den komplekse biologiske mekanisme bag sygdomme såsom Parkinsons for i sidste ende at kurere disse.
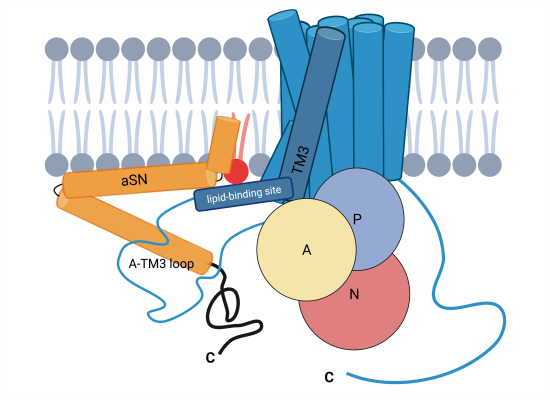
Proteinet alfa-synuclein (aSN) har længe været kendt som en hovedårsag til f.eks. Parkinsons sygdom og Lewy Body Demens, når det danner klumpede proteinaggregater, der ødelægger cellefunktionen – men aSN i sin naturlige form, uden at klumpe, har ikke haft en konkret, kendt funktion.
Et internationalt forskerhold ledet af Poul Nissen og Poul Henning Jensen fra DANDRITE har nu påvist, at naturlig aSN er en vigtig aktiveringsfaktor for en vigtig calciumpumpe i cellemembranen kendt som PMCA (plasmamembran Ca2+-ATPase), hvorimod sammenklumpet aSN ser ud til at miste denne effekt. Tidligere var proteinet calmodulin den eneste kendte aktiveringsfaktor af PMCA, men forskerne tilføjer nu endnu en vigtig aktør og viser, at aktiveringen af PMCA med aSN foregår i negativt ladede membranmiljøer, komplementært med calmodulin, der virker i neutrale og evt. positivt ladede lipidmiljøer.
Poul Nissen forklarer:
”Aktiveringen ser ud til at have særlig betydning i det såkaldte præsynaptiske område af neuroner, som er ansvarlig for at transmittere signaler i hjernens neurale netværk. Det er kendt, at aSN akkumuleres i det præsynaptiske område, og vore undersøgelsen viser for det første, at aSN og PMCA optræder sammen i dette område. Dertil kommer, at aSN stimulerer calcium-udskillelse fra neuroner, og ikke mindst at aSN øger PMCA's aktivitet markant.”
Ydermere viser forskerne ved matematisk netværksmodellering, at PMCA-aktivering sandsynligvis er af afgørende betydning for calcium-ligevægten (homeostasen), når neuroner signalerer gentagne gange, og calcium derfor konstant trænger ind i cellen. ASN's aktivering af PMCA forhindrer således en koncentration af calcium, som ville blive giftig for cellen.
Poul Henning Jensen udtaler:
”Vores laboratorium har tidligere vist, at tidlige klumpstadier af aSN aktiverer en anden calciumpumpe, SERCA, som sidder i et indre organel i cellen (endoplasmatisk retikulum), men SERCA aktiveres ikke meget af opløseligt aSN. Modsat aktiveres PMCA meget af opløseligt aSN og næsten ikke af klumpet aSN.”
Calciumregulering af PMCA og SERCA er vigtig for alle celler, ikke mindst neuroner, så hvis en patologisk tilstand er forbundet med overgangen fra naturligt aSN til klumpet aSN, sker der også et skift i aSN-aktiveringen fra PMCA til SERCA, og calciumreguleringen påvirkes dermed kraftigt. Det ændrer et væld af processer og fører i sidste ende til celledød.
Den afgørende rolle for calciumregulering
Calciumregulering er grundlæggende for funktionen af alle celler, herunder neuroner. Det spiller en afgørende rolle i signaltransmission, især i det præsynaptiske område, hvor naturligt aSN normalt findes. Når aSN klumper, forrykkes denne balance derfor fra PMCA- til SERCA-aktiveret calciumregulering, og det ændrer calciumbalancen i celler. Dette menes at finde sted tidligt i sygdomme som Parkinsons.
Denne nye forståelse af aSN's dobbelte rolle i calciumregulering kan have afgørende konsekvenser for at afsløre de tidlige sygdomsprocesser, især i Parkinsons sygdom. Ved at identificere skiftet fra naturlig aSN-aktivering af PMCA til klumpet aSN-aktivering af SERCA, kan forskere få indsigt i de mekanismer, der ligger til grund for opståen og tidlig udvikling af neurodegenerative tilstande.
Fremtidig forskning og terapeutisk potentiale
I takt med at forskere fortsætter med at udforske det komplekse forhold mellem aSN og calciumpumper, kan det åbne døren til potentielle diagnostiske og terapeutiske strategier, der sigter mod at undersøge og reducere de tidlige forstyrrelser i calciumreguleringen.
Opdagelsen af naturlig aSN's rolle i aktivering af calciumpumpe er et centralt skridt i retning af at forstå den komplekse biologiske mekanisme bag neurodegenerative sygdomme for i sidste ende at kurere disse.
DANDRITE opbygger pt. stærke positioner på studier af nye indsigter i synaptisk calciumsignalering i både den sunde tilstand og under betingelser af Parkinsons sygdom. Ny DANDRITE gruppeleder Chao Sun har eksempelvis etableret et forskningsprogram til lokalisering og tracking af de individuelle molekylære aktører i synapser, der regulerer calciumsignalering. Målet er at opnå en langt mere præcis og operationel forståelse af tidlige, afgørende ”tipping points” i neurodegenerative lidelser, og hvordan man kan styre uden om disse.
Forskningsresultaterne blev offentliggjort i det internationale tidsskrift EMBO Journal.
Mere information
Professor Poul Nissen
Institut for Molekylærbiologi og Genetik & DANDRITE
Aarhus Universitet
Email: pn@mbg.au.dk. mobile: +4528992295
SUPPLERENDE OPLYSNINGER
Vi bestræber os på, at alle vores artikler lever op til Danske Universiteters principper for god forskningskommunikation. På den baggrund er artiklen suppleret med følgende oplysninger:
Studietype | Eksperiment The work is based on a large, international collaboration with many types of data. From Poul Henning Jensen’s and Poul Nissen’s labs at Aarhus University: postdocs Antoni Kowalski (also in the Langkilde lab, Univ. Copenhagen), Cristine Betzer, Sigrid Thirup Larsen, Emil Gregersen and Montaña Bermejo investigated aSN activation of PMCA based on both biochemical and cell biological data (in the final stage of revision also with help from Christine Ernstsen and Lene Nejsum, AU Clinical Medicine, and from Shweta Jain and Robert Edwards, University of California San Francisco). Sigrid Thirup Larsen also analysed transcriptomics data, assisted by visiting student Alicia Espiña Bou. Copenhagen: Estelle Newcombe, Birthe Kragelund and Annette Langkilde performed NMR studies of the dynamic interaction of aSN with PMCA. Berlin and Aarhus: Master student Viktor Bendtsen from the Nissen lab collaborated with Jorin Diemer and Edda Klipp from the Humboldt University in Berlin on mathematical network modeling. |
Ekstern finansiering | This work was supported by a “Mobility plus, 3rd edition” fellowship grant of the Polish Ministry of Science and Higher Education to A.K., a postdoctoral research grant from the Extremadura Province (PO17009) to M.C.B., by a PhD stipend from the Aarhus Graduate School of Science at Aarhus University to S.T.L., by a collaborative grant from H. Lundbeck A/S to P.H.J., by Lundbeck Foundation grants R223-2015-4222 for P.H.J. and R248-2016- 2518 for Danish Research Institute of Translational Neuroscience-DANDRITE, Nordic-EMBL Partnership for Molecular to P.N and P.H.J., and by funds from a project 2 research grant from the Independent Research Fund Denmark (7014-00328B) and the Brainstruc research center (R155-2015-2666) and a professorship grant (R310-2018-3713) of the Lundbeck Foundation to P.N. Further support was given by the European Union’s Horizon 2020 research and innovation programme under the Marie Sklodowska-Curie grant agreement No. 101023654, awarded to E.A.N. and the Novo Nordisk Foundation (#NNF18OC0033926 to B.B.K). All NMR data were recorded at cOpenNMR, an infrastructure facility funded by the Novo Nordisk Foundation (#NNF18OC0032996). The mathematical modeling work was funded by the Deutsche Forschungsgemeinschaft (DFG, German Research Foundation) under Germany ́s Excellence Strategy – The Berlin Mathematics Research Center MATH+ (EXC-2046/1, project ID: 390685689) to E.K. |
Interessekonflikt | Ingen |
Link til den videnskabelige artikel | Antoni Kowalski, Cristine Betzer, Sigrid Thirup Larsen, Emil Gregersen, Estella A. Newcombe, Montaña Caballero Bermejo, Viktor Wisniewski Bendtsen, Jorin Diemer, Christina V. Ernstsen, Shweta Jain, Alicia Espiña Bou, Annette Eva Langkilde, Lene N. Nejsum, Edda Klipp, Robert Edwards, Birthe B. Kragelund, Poul Henning Jensen, Poul Nissen
Department of Molecular Biology and Genetics, Aarhus University, Aarhus, Denmark Department of Biomedicine, Aarhus University, Aarhus, Denmark Danish Research Institute of Translational Neuroscience – DANDRITE, Aarhus University, Aarhus, Denmark REPIN and Structural Biology and NMR Laboratory, Department of Biology, University of Copenhagen, Denmark Department Biochemistry and Molecular Biology and Genetics, IBMP, University of Extremadura, Badajoz, Spain Theoretical Biophysics, Humboldt-Universität zu Berlin, Berlin, Germany Department of Clinical Medicine, Aarhus University, Aarhus N, Denmark Departments of Neurology and Physiology, University of California San Francisco, San Francisco, CA. Department of Drug Design and Pharmacology, University of Copenhagen, Denmark
“Monomeric α-Synuclein activates the Plasma Membrane Calcium Pump” |
