Zebrafisk lader dig se nanopartiklers skæbne i den levende organisme
Har du nogensinde forestillet dig, at du kunne se gennem en levende organismes krop og observere det dynamiske samspil mellem celler og nanopartikler, der er injiceret i blodet? Dette er nu muligt, da brugen af transgene zebrafiskeembryoner giver en unik mulighed for dette ved såkaldt intravital mikroskopi.

Mere end 99% af den samlede tilførte nanopartikeldosis når ikke de tumorer, som de er rettet mod. Dette viser den fælles udfordring, vi står overfor i dag med hensyn til udvikling af en målrettet metode til at transportere lægemidler et ønsket sted hen i kroppen. Leveren er et af de organer, der især er kendt for effektivt at rense blodet for nanopartikler, der injiceres intravenøst - en typisk metode til systemisk tilførsel af lægemidler. Hvordan denne hurtige mekanisme til rensning af blod opnås er endnu ikke kendt, hvilket bl.a. skyldes tekniske vanskeligheder ved bio-visualisering af nanopartikler med enkelt celle-opløsning. Et internationalt forskerhold, der samler forskere fra Danmark, Tyskland og Italien, har nu etableret en zebrafiskebaseret metode til at visualisere selve processerne i realtid og med ultrastrukturel opløsning.
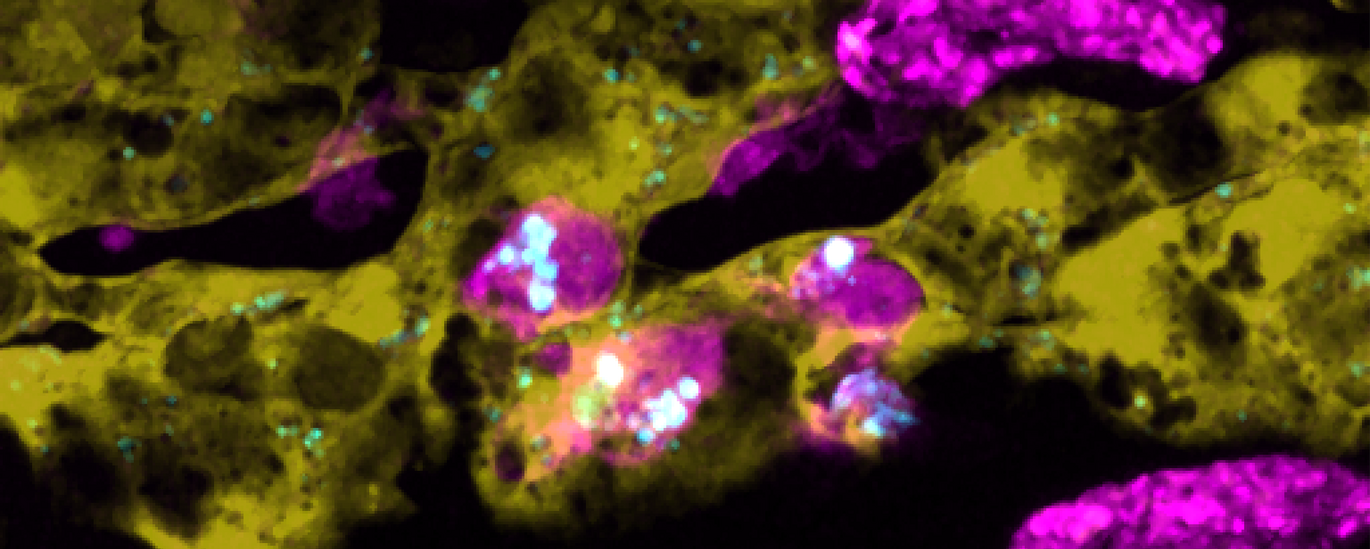
Forskerne fokuserede på to celletyper, der er bevaret på tværs af hvirveldyr: makrofager og scavenger endotelceller. De er kendt som ”skraldemænd” i direkte kontakt med blodbanen, og den funktionelle ækvivalent i vores krop er henholdsvis såkaldte Kupffer-celler og leversinusoid endotelceller, der findes i leverens blod-vævgrænseflade. Transgene zebrafiskembryoer kan gøre dem synlige ved hjælp af genetisk kodede fluorescerende proteiner, og sammen med fluorescensmærkede nanopartikler afslørede forskerne, hvordan cirkulerende nanopartikler næsten udelukkende fanges af disse celler inden for en tidsramme på få minutter til timer efter injektion i blodet. Den realtids flerfarvede visualiseringsstrategi blev yderligere kombineret med elektronmikroskopimetoder for at muliggøre (korrelativ) analyse af vævsultrastrukturer til entydigt at detektere nanopartikler, der optages ved endocytose og efterfølgende lokaliseres i subcellulære rum.
Disse fund viser, at zebrafisk er specielt velegnede som modeldyr til i kombination af genetisk manipulation og intravital billeddannelse at give ny spændende indsigt i mekanismerne til fjernelse af nanopartiklerne fra blodstrømmen. Denne proces blev førhen betragtet som "usynlig". Zebrafisk begynder således nu at fremstå som et attraktivt værktøj til at hjælpe udviklingen af ??bionanomaterialer mod sikrere og mere effektiv design.
Denne undersøgelse er et led i en igangværende forskning ledet af Yuya Hayashi ved Aarhus Universitet og hans internationale samarbejdspartnere Carsten Weiss og Uwe Strähle ved Karlsruhe Teknologiske Institut (KIT), Tyskland. Samarbejdet blev muligt via to på hinanden følgende postdocbevillinger fra Det Frie Forskningsråd | Teknologi og Produktion og Lundbeck Foundation til Yuya Hayashi.
Den danske del af forskningen blev udført med hjælp fra zebrafiskefaciliteten ledet af Kasper Kjær-Sørensen og Claus Oxvig ved Institut for Molekylærbiologi og Genetik, Aarhus Universitet.
Den videnskabelige artikel er offentliggjort i det højt anerkendte tidsskrift ACS Nano.
"Differential Nanoparticle Sequestration by Macrophages and Scavenger Endothelial Cells Visualized in Vivo in Real-Time and at Ultrastructural Resolution" by Yuya Hayashi*, Masanari Takamiya, Pia Bomholt Jensen, Isaac Ojea-Jiménez, Hélicia Claude, Claude Antony, Kasper Kjær-Sørensen, Clemens Grabher, Thomas Boesen, Douglas Gilliland, Claus Oxvig, Uwe Strähle, and Carsten Weiss.
ACS Nano 14 (2020) pp. 1665-1681. https://doi.org/10.1021/acsnano.9b07233.
Film (se filmen)
Makrofager (magenta) med internaliserede nanopartikler (cyan), der kravler langs den indre side af blodkar (gul). Tre dage gamle Tg(fli1a: eGFP); Tg(mpeg1: mCherry) embryoner blev injiceret med Pacific Blue-mærket 70 nm Si02-nanopartikler (2 ng). Time-lapse-billeddannelse blev udført i intervaller på hver 16 sekunder i 15 minutter ved 1-4 hpi. (Genoptrykt fra Hayashi et al. (2020) ACS Nano. Copyright 2020 American Chemical Society)
Mere information
Adjunkt Yuya Hayashi
Institut for Molkylærbiologi og Genetik
Aarhus Universitet
yuya.hayashi@mbg.au.dk
