Afdækning af en unik mekanisme som hæmmer enzymer, der findes i vores hud
Forskere fra Institut for Molekylærbiologi og Genetik, AU, har bestemt strukturerne af en proteasehæmmer kaldet A2ML1, som findes i huden hos mennesker. Mutationer i A2ML1 er forbundet med en alvorlig autoimmun sygdom med dårlige behandlingsmuligheder, og de nye resultater bidrager til en bedre forståelse af, hvorfor funktionen af A2ML1 er forstyrret af disse sygdomsassocierede mutationer.
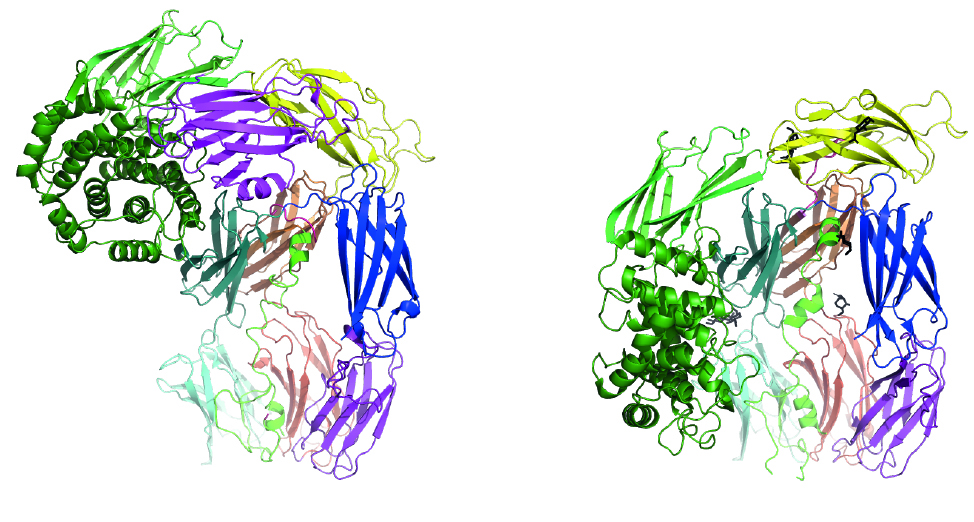
Proteasehæmmere hæmmer enzymer (proteaser) der spalter peptidbindinger i andre proteiner. Proteaser er den største gruppe af enzymer i det humane genom. De kan anvendes sammen til behandling af forskellige sygdomme, og der er stor fokus på at forstå, hvorledes de forskellige proteaser og deres hæmmere agerer.
Forskerne fra Aarhus Universitet studerer blandt andet proteasehæmmere fra Alfa-makroglobulin (AM) familien, der anvender en unik fangstmekanisme, hvilket gør det muligt for dem at hæmme proteaser af enhver katalytisk type. Den bedst kendte AM-proteasehæmmer er A2M, en stor tetramer, der cirkulerer i blodet i høje koncentrationer.
Begge professorer involveret i denne undersøgelse, Jan J. Enghild og Gregers R. Andersen, begyndte at studere strukturen og funktionen af A2M og relaterede proteiner for over 30 år siden. Den strukturelle bestemmelse af A2M viste sig imidlertid at være kompliceret pga. dens store størrelse og en usædvanlig ikke-kompakt struktur. Da Jan Enghild blev opmærksom på, at en monomerisk AM-proteasehæmmer alfa-2-makroglobulin-lignende 1 (A2ML1), som findes i huden på mennesker, så han chancen for at vende tilbage til et uafsluttet kapitel fra sit tidligere arbejde.
SeanDean Lykke Harwood arbejdede som ph.d.-studerende i Jan Enghilds laboratorium, og han etablerede hurtigt en protokol for rekombinant ekspression og oprensning af A2ML1. Postdoc Nadia Sukusu Nielsen begyndte at udføre biokemiske eksperimenter for at studere funktionen af A2ML1, og snart blev Gregers Rom Andersen overtalt til at hjælpe med strukturbestemmelsen af proteinet.
Gennem hårdt arbejde lykkedes det Nadia at lave krystaller af A2ML1, og et groft omrids af molekylet kunne ses baseret på disse krystallografiske data, men de atomare detaljer forblev et mysterium.
I mellemtiden blev et nyt cryo-EM-anlæg på Aarhus Universitet taget i brug, og postdoc Alessandra Zarantonello begyndte i samarbejde med Gregers Rom Andersen at lave grids til cryo-EM for at afprøve denne nye strukturbestemmelsesmetode. Ved at bruge et af de første cryo-EM 3D-kort lavet af Alessandra blev fortolkningen af krystallografiresultaterne enormt forbedret. Gregers var imponeret og besluttede at lade Alessandra fokusere helt på cryo-EM.
Nadias og Alessandras samarbejde fortsatte, da en enkelt struktur ikke var nok! De ville først være tilfredse, når de havde strukturer af A2ML1 i kompleks med en protease. For at opnå dette forberedte Nadia flere højkvalitetsprøver, hvor A2ML1 var meget specifikt spaltet af en protease, og protease-A2ML1-komplekserne blev isoleret gennem optimerede oprensningsprotokoller. Disse prøver gav et endnu bedre 3D cryo-EM-kort end de oprindelige ikke-spaltede A2ML1-prøver. Gennem hele processen havde Alessandra og Nadia stor støtte fra personalet på cryo-EM-faciliteten på Aarhus Universitet, som gjorde det muligt for dem at indsamle data hjemmefra under de nedlukninger, pandemien medførte.
Resultaterne giver en detaljeret forståelse af funktionen af A2ML1, men forbedrer også forståelsen af andre relaterede proteiner hos mennesker.
SUPPLERENDE OPLYSNINGER, HERUNDER KONTAKTOPLYSNINGER
Vi bestræber os på, at alle vores artikler lever op til Danske Universiteters principper for god forskningskommunikation. På den baggrund er artiklen suppleret med følgende oplysninger:
PUNKTER | INDHOLD OG FORMÅL |
Studietype | Eksperiment |
Ekstern finansiering | The Independent Research Foundation Denmark, the LEO Foundation, the VELUX Foundation, the Novo Nordisk Foundation, and the Lundbeck Foundation |
Interessekonflikt | Forskerne erklærer, at der ingen interessekonflikter er. |
Link til videnskabelig artikel | Cryo-EM structures of human A2ML1 elucidate the protease-inhibitory mechanism of the A2M family Nadia Sukusu Nielsen, Alessandra Zarantonello, Seandean Lykke Harwood, Kathrine Tejlgård Jensen, Katarzyna Kjøge, Ida B. Thøgersen, Leif Schauser, Jesper Lykkegaard Karlsen, Gregers R. Andersen, Jan J. Enghild Nature Communications |
Kontaktdata | Professor Jan J. Enghild |
