Kædereaktion i menneskets immunforsvar fanget i krystaller
Et forskerteam fra Aarhus Universitet har afsløret detaljer i, hvordan en kædereaktion i menneskets immunforsvar starter. Med disse resultater håber forskerne at kunne afhjælpe lidelser forårsaget af uønsket aktivering af immunforsvaret.
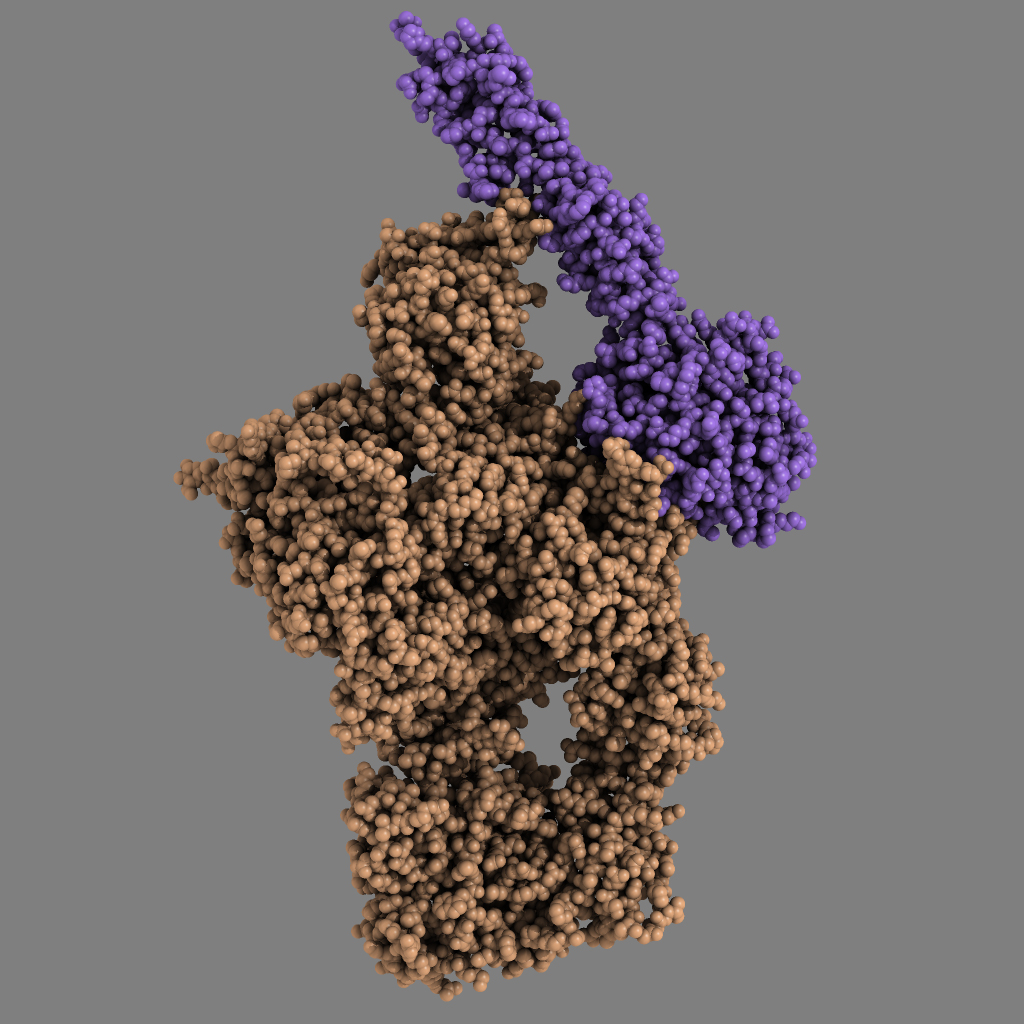
Komplementsystemet er en del af det medfødte immunforsvar og er sammensat af omkring 40 forskellige proteiner, der samarbejder om at forsvare kroppen mod sygdomsfremkaldende mikroorganismer. Komplementsystemet opfatter faresignaler i kroppen ved at genkende karakteristiske molekylære mønstre på fx sygdomsfremkaldende mikroorganismer eller nogle af vores egne celler, som er syge eller døende og derfor skal elimineres.
Komplementsystemet findes bl.a. i blodet, men også i vævene i den væske, der omgiver cellerne og virker som den første forsvarslinje mod mange sygdomsfremkaldende organismer. Genkendelsen af faresignalerne varetages af specialiserede proteiner i komplementsystemet.
Professor Steffen Thiel på Institut for Biomedicin ved Aarhus Universitet har i mere end 20 år været verdensførende i studier af proteinerne MBL og MASP-2, der er to centrale proteiner i komplementsystemet. Når MBL genkender faresignalet, omdannes MASP-2 til et aktivt enzym, som nu kan kløve proteinet C4, et tredje vigtigt protein i komplementsystemet. Denne spaltning er første trin i en kædereaktion, som ender med eliminering af fx sygdomsfremkaldende bakterier. Det er nu lykkedes et forskerteam ledet af lektor Gregers R. Andersen på Institut for Molekylærbiologi og Genetik ved Aarhus Universitet – i samarbejde med Steffen Thiel – at bestemme i atomare detaljer, hvorledes det aktive enzym MASP-2 genkender substratet C4.
Krystaller beskydes med røntgenstråling
To ph.d.-studerende i molekylærbiologi, Rune T. Kidmose og Nick S. Laursen, isolerede proteinet C4 fra blodplasma, mens de fik MASP-2 fra ungarske kollegaer. Dernæst krystalliserede de substratet C4 alene, men til deres overraskelse kunne de også krystallisere enzym-substrat komplekset C4·MASP-2. Ved at beskyde de dannede krystaller med intens røntgenstråling lykkedes det inden for et år de to studerende at bestemme de atomare strukturer af C4 og C4·MASP-2 komplekset. De fik dernæst hjælp af to andre ph.d.-studerende, Sofia Sirotkina og Troels R. Kjaer, som ved hjælp af laboratorieforsøg kunne vise, at Rune Kidmose og Nick Laursens konklusioner baseret på deres krystaller var korrekte, når MASP-2 spaltede C4 i et reagensglas.
Potentiel betydning for udvikling af lægemidler
Resultaterne opnået af Rune T. Kidmose og Nick S. Laursen er enestående. ”Det er uhyre sjældent, at man kan fange et proteolytisk (proteinnedbrydende) enzym midt i processen med at spalte et intakt protein”, udtaler de studerendes vejleder Gregers Rom Andersen. ”Vi ved nu i detaljer, hvilke dele af MASP-2, som genkender substratet C4. Et andet fascinerende aspekt ved resultaterne er, at vi også kender strukturen af både C4 og MASP-2 alene, så vi kan se, hvordan både enzymet og substratet ændrer deres tredimensionelle struktur, når C4 genkendes af MASP-2. Vi kan også se hvorledes disse ændringer direkte medvirker til at fremme spaltningen af C4”, afslutter vejlederen.
For Steffen Thiel er de nye resultater en helt ny måde at få visualiseret, hvorledes MASP-2 – som han selv opdagede funktionen af i 1997 – udfører sin funktion. ”Det er også en stor personlig glæde at kunne være med helt fra opdagelsen af et nyt protein til at få en viden på atomar skala om, hvorledes det kan fungere som et enzym”, siger han.
Der sker i flere tilfælde en uheldig aktivering af komplementsystemet, som kan lede til skader på vores eget væv. Flere medicinalfirmaer arbejder lige nu på at udvikle lægemidler, der kan stoppe disse ødelæggelser. ”Den meget detaljerede forståelse vi nu har opnået omkring dele af komplementsystemet vil givet indgå i mere intelligente måder at udvikle ny medicin på”, udtaler Steffen Thiel, og fortsætter ”Vi stopper selvfølgelig ikke vores undersøgelser her, da vi vil forsætte de meget detaljerede studier af andre dele af immunforsvaret”.
De nye resultater fra Aarhus Universitet er netop offentliggjort i det ansete tidsskrift Proceedings of the National Academy of Science (PNAS).
Rune T. Kidmosea, Nick S. Laursena, József Dobób, Troels R. Kjaerc, Sofia Sirotkinaa, Laure Yatimea, Lars Sottrup-Jensena, Steffen Thielc, Péter Gálb, and Gregers R. Andersena
Departments of aMolecular Biology and Genetics and cBiomedicine, Aarhus University, DK-8000 Aarhus, Denmark; and bInstitute of Enzymology, Research Centre for Natural Sciences, Hungarian Academy of Sciences, H-1113, Budapest, Hungary
Mere information
Lektor Gregers Rom Andersen
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
gra@mb.au.dk – 871 55507
Professor Steffen Thiel
Institut for Biomedicin
Aarhus Universitet
st@microbiology.au.dk – 29270890
Tekst: Gregers Rom Andersen og Lisbeth Heilesen
