Kendt RNA-molekyle findes alligevel ikke i kræftceller
Et såkaldt cirkulært RNA-molekyle, som man mente var kræftfremkaldende, findes alligevel i ikke i kræftceller. Et dansk forskerhold har offentliggjort de nye resultater i <em>Nature Communications</em>.
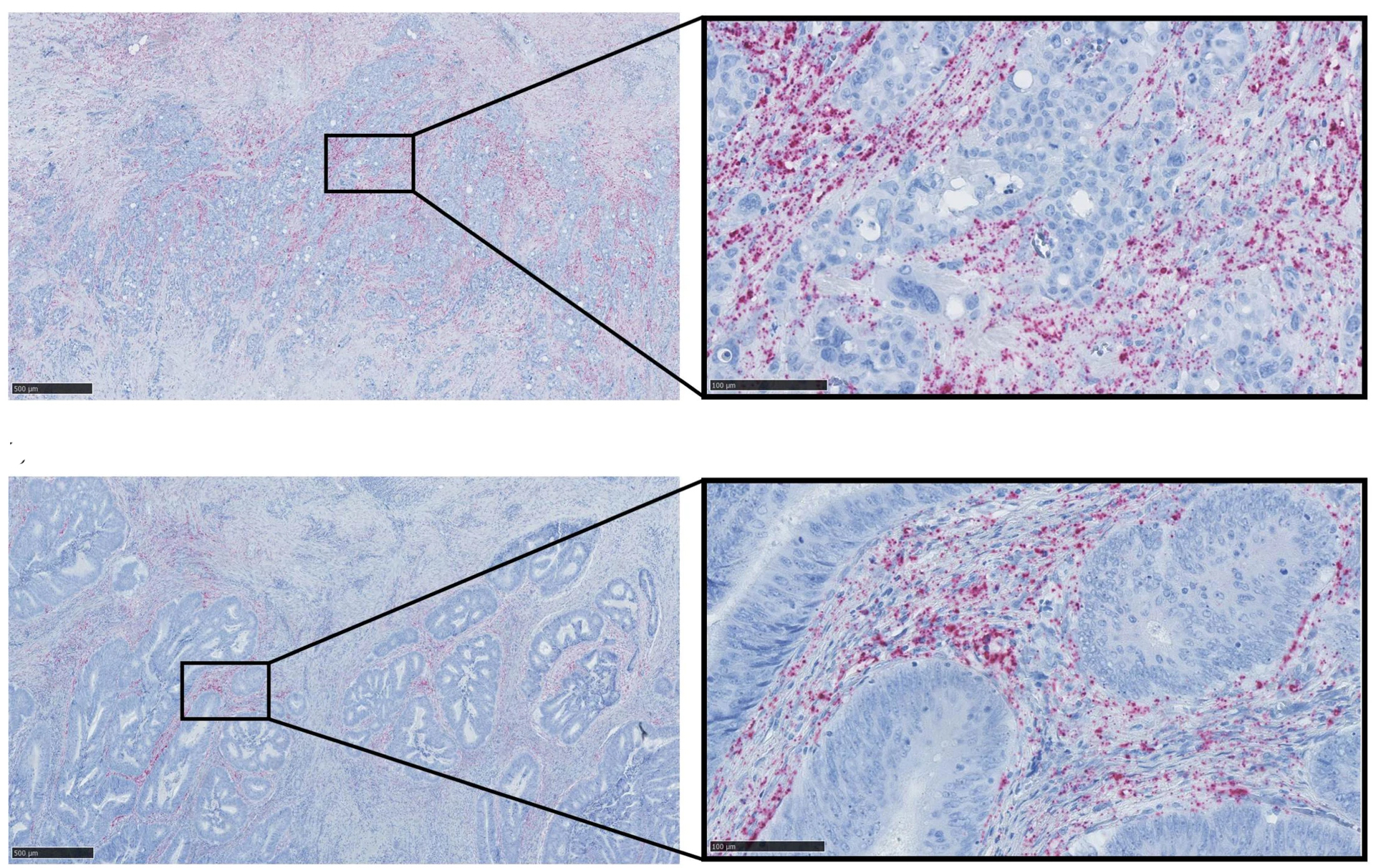
Man har traditionelt set på kræft som genetiske sygdomme, der skyldes mutationer i vigtige gener, men det er gradvist blevet mere og mere tydeligt, at mange andre typer af forandringer i cellerne bidrager til kræftens opståen og udvikling - såkaldte epigenetiske forandringer. Dette kan f.eks. være kemiske modifikationer på DNA-niveau, der påvirker, hvor meget proteinprodukt et givet gen giver ophav til, uden at der ændres i selve genets DNA-sekvens, men også igennem såkaldte mikroRNA molekyler, der virker ved – post-transskriptionelt – at regulere geners aktivitet.
I løbet af de seneste år har man desuden opdaget en ny gruppe af biomolekyler, de såkaldte cirkulære RNA-molekyler, som man har fundet kan binde til og hæmme mikroRNA-molekyler, og derved tilføjes endnu et lag i den komplekse regulering af menneskets gener.
Vi har fornyligt været vidne til en eksplosion af forskningsaktivitet inden for dette nye forskningsområde, men et dansk forskerhold viser i et nyt studie, der er offentliggjort i Nature Communications, at mange af de første studier af cirkulært RNA i kræft formentligt har draget forhastede konklusioner, hvilket primært skyldes en mangel på spatiale analyser.
Kræft skal ses som et komplekst sammenspil mellem kræftceller og godartede celler
Vi ser således, at et ellers meget velbeskrevet cirkulært RNA molekyle, kaldet ciRS-7, i virkeligheden slet ikke er tilstede i kræftcellerne i en række hyppigt forekommende kræftformer, på trods af at den er beskrevet som værende et kræftfremkaldende molekyle, der skulle virke ved at binde den kræfthæmmende mikroRNA, kaldet miR-7 i kræftcellerne.
I stedet ser vi, at andre godartede celletyper i en kræftknude udtrykker meget høje niveauer af ciRS-7, hvilket tyder på, at den måske i stedet bidrager til kræftudviklingen igennem det såkaldte mikromiljø, der findes i en kræftknude.
Lasse Sommer Kristensen: ”Vores resultater viser med alt tydelighed, hvor vigtigt det er, at se på kræft som et komplekst sammenspil mellem kræftcellerne og de mange andre typer af godartede celletyper, man finder i en kræftknude, når man forsøger at forstå de molekylære mekanismer, der bidrager til kræftudviklingen.”
Med andre ord kan de klassiske kræftcellelinjer man dyrker i laboratoriet – og ofte bruger til at forsøge at forstå nye molekylære mekanismer – ikke altid give os et retvisende billede af, hvad der er på spil i en egentlig kræftknude.
Desuden er de danske forskeres resultater et godt eksempel på, at spatiale analyser af patienters kræftknuder kan bidrage med vigtig viden, som man ikke ville have fået ved - på traditionel vis - at analysere alt DNA eller RNA fra en kræftknude (både deriveret fra kræftceller og godartede celler) i en samlet analyse.
Artiklen er offentliggjort i Nature Communications.
https://doi.org/10.1038/s41467-020-18355-2
Mere information
Lektor Lasse Sommer Kristensen
Tidligere: Institut for Molekylærbiologi og Genetik/iNANO
Nu: Institut for Biomedicin, Aarhus Universitet
lasse@biomed.au.dk
Professor Jørgen Kjems
Institut for Molekylærbiologi og Genetik (MBG)
Interdisciplinary Nanoscience Center (iNANO)
Aarhus Universitet
+45 28992086 - jk@mbg.au.dk
Klinisk lektor Henrik Hager
Klinisk Patologi
Sygehus Lillebælt
Henrik.Hager@rsyd.dk
