Lægemidlet eculizumab fanget i aktion
Ved brug af røntgenstråling har forskere fra Aarhus Universitet i samarbejde med Alexion Pharmaceuticals, Inc., belyst, hvordan det antistof-baserede lægemiddel eculizumab forhindrer vores immunsystem i at ødelægge røde blodlegemer og væv i nyren.
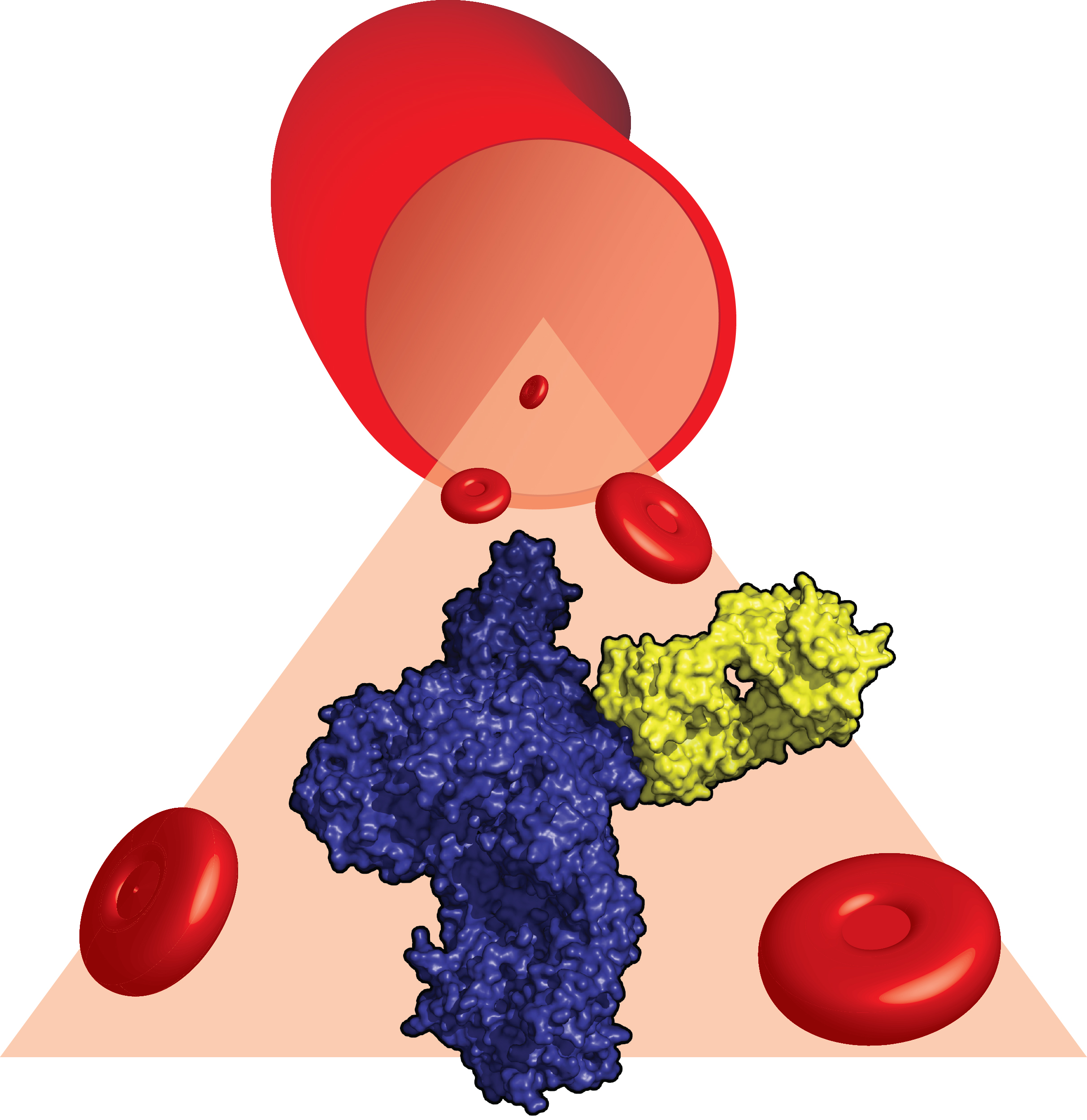
Forskerne fra Aarhus har studeret et vigtigt protein fra vores immunsystem, kaldet C5. Når kroppen inficeres af sygdomsfremkaldende organismer, bliver C5 kløvet af enzymer i blodet som et led i immunsystemets forsvarsmekanisme. De to C5 fragmenter som herved dannes rekrutterer immunceller til at bekæmpe og slå de patogene organismer ihjel.
Normalt er kroppens egne celler beskyttet mod de ødelæggende mekanismer, der udløses som følge af C5 kløvning. Men i patienter som lider af sygdommene paroxystisk nocturn hæmoglobinuri (PNH) og atypisk hæmolytisk uræmisk syndrom (aHUS) mistes denne kontrol på grund af mutationer i patienternes DNA. De to sygdomme er karakteriseret ved, at røde blodlegemer og celler i nyren konstant bliver beskadigede, og af denne grund kan PNH og aHUS lidelserne være livstruende. Det globale biofarmaceutiske firma Alexion har udviklet det antistof-baserede lægemiddel eculizumab, som forhindrer kløvningen af C5 og derfor bliver brugt i behandlingen af PNH og aHUS.
Arbejdet er udført af ph.d.-studerende Janus Asbjørn Schatz-Jakobsen og professor Gregers Rom Andersen fra Institut for Molekylærbiologi og Genetik ved Aarhus Universitet sammen med forskere fra Alexion og er netop offentliggjort i The Journal of Immunology, hvor en figur fra artiklen trykkes på forsiden af tidsskriftets juli-udgave.
Beskrivelse af forskningsprojektet
Forskningsprojektet startede med, at Janus oprensede C5 proteinet fra humant blodplasma. Herefter blandede han det helt rene C5 med et fragment af eculizumab, som Alexion havde fremstillet udelukkende til samarbejdet med forskerne i Aarhus. Efter utallige forsøg lykkedes det Janus at danne krystaller af C5 bundet til antistoffragmentet. Janus testede over 200 krystaller ved at beskyde disse med meget kraftfuld røntgenstråling på en stor international facilitet i Frankrig. Halvandet års hårdt arbejde resulterede i, at Janus til sidst var i stand til at beskrive den atomare struktur af C5 bundet til eculizumab fragmentet. Denne struktur afslører hvordan antistoffet skaber en fysisk barriere som forhindrer de kløvende enzymer i at genkende C5.
På den anden side af Atlanten udførte forskere ved Alexion parallelt med Janus’ arbejde biokemiske forsøg på versioner af eculizumab antistoffet med mutationer i specifikke regioner, der er væsentlige for at antistoffet kan binde C5 proteinet.
Janus Asbjørn Schatz-Jakobsen forklarer: "Da jeg havde færdiggjort arbejdet med min atomare model, gik der noget tid, før vi fik resultaterne fra Alexion. Det var næsten som at være et lille barn, der venter på juleaften. Da vi modtog resultaterne på mail, var vi meget hurtigt i stand til at konstatere stor korrelation mellem vores resultater og de biokemiske data fra Alexion, hvilket bekræftede kvaliteten og relevansen af min model. Dette var en stor lettelse, og resultaterne fra Alexion var tilmed i stand til at belyse nye aspekter af min atomare model, som vi ikke havde bemærket i første omgang."
Den nye forskning har ydermere hjulpet forskerne fra Aarhus Universitet til en bedre forståelse af, hvordan C5 bliver kløvet af enzymer, når eculizumab ikke er til stede. På Alexion bliver modellen nu brugt til i detaljer at forstå, hvordan deres lægemiddel virker, og hvordan det er i stand til at behandle de to sygdomme.
Læs artiklen, som er publiceret i The Journal of Immunology.
Mere information
Professor Gregers Rom Andersen
gra@mbg.au.dk - mobil: 3025 6646
Ph.d.-studerende Janus Asbjørn Schatz-Jakobsen
janusasj@mbg.au.dk - Tlf. 8715 4201
Institut for Molekylærbiologi og Genetik
Aarhus Universitet
