Ny viden kan formindske skader efter hjerneblødning
Danske forskere finder vigtigt nyt om fællestræk ved udvikling af Alzheimers sygdom, type II diabetes, maniodepressive lidelser og celledød efter hjerneblødning, der kan muliggøre en tidlig forebyggelse og behandling.
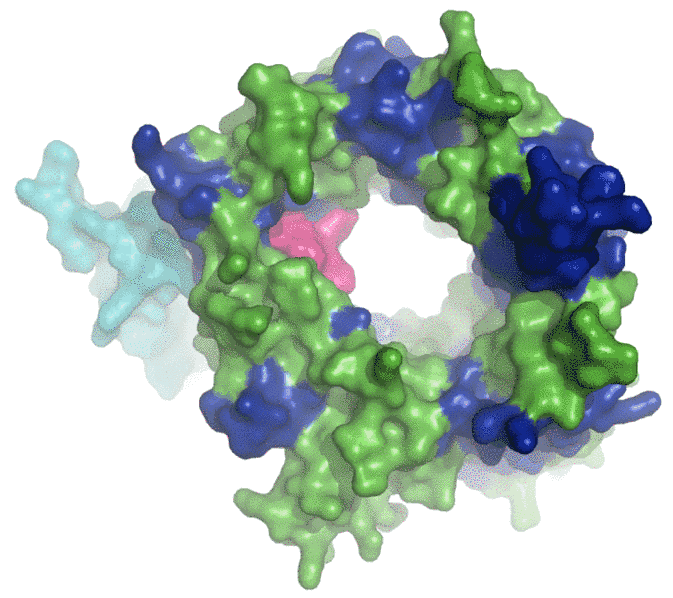
Forskere ved Lundbeckfondens MIND Center ved Aarhus Universitet offentliggør i tidsskriftet Nature Structural and Molecular Biology den tre-dimensionelle atomare struktur af proteinet sortilin. Sortilin er medvirkende til celledød i hjernen efter blødninger og blodpropper. Den nye viden om strukturen giver en dybere forståelse af visse grundlæggende processer, der er aktive ved celledød i hjernen, ved udviklingen af Alzheimers sygdom, type II diabetes og maniodepressive lidelser. Kendskabet til sortilins struktur vil gøre det muligt at designe en molekylær markør, der gør det nemmere at se forskel på normale og syge celler og dermed forbedre mulighederne for en tidlig forebyggende eller behandlende indsats.
Bestemmelsen af sortilins struktur er et resultat af det mangeårige samarbejde mellem forskergrupper på Institut for Medicinsk Biokemi og Molekylærbiologisk Institut ved Aarhus Universitet under ledelse af henholdsvis professor Claus Munck Petersen og lektor Søren Thirup.
Opdagelsen af sortilin-proteinet
Sortilin blev første gang isoleret i 1997 ved Institut for Medicinsk Biokemi, Aarhus Universitet, hvor det i 2004 også blev vist, at sortilin under visse omstændigheder er skyld i hjernecellers død. Det har siden vist sig, at sortilin er en ud af en familie på fem meget nært beslægtede proteiner, som er involverede i så forskellige sygdomme som Alzheimers, type II diabetes og maniodepressive lidelser.
Sortilin findes især i hjernevæv, hvor det sidder bundet på overfladen af celler og kan binde til andre proteiner (ligander). En af disse ligander kan - når den binder til sortilin - få cellen til at begå selvmord, hvilket er det der sker i forbindelse med blodpropper og blødninger i hjernen.
Adskillige vidt forskellige ligander til sortilin er blevet identificeret, og hidtil har det været en gåde, hvorfor ingen af dem kan binde til sortilin på samme tid. Det er imidlertid indlysende nu, hvor strukturen er bestemt. Sortilin viser sig nemlig at være den hidtil største såkaldte propel-struktur (se figur) og det giver plads til en central tunnel, hvor liganderne hver især kan genkendes specifikt. Men fordi det er en tunnel, er der kun plads til en ligand af gangen.
Design af nye markører
Ved hjælp af strukturen kan forskerne forhåbentligt nu designe en ligand til sortilin, som vil forhindre andre ligander i at binde og dermed forhindre hjerneceller i at begå selvmord. Selvom det er nærliggende at tro, at den samme mekanisme forekommer i Alzheimers sygdom, er dette ikke tilfældet. Ved Alzheimer er det proteinet APP, der på grund af mangel på proteinet SorLA (medlem af sortilin familien), bliver nedbrudt forkert og forårsager skader i hjernen. Her håber man at kunne udvikle en markør, så man ved hjælp af hjerne-scanning kan stille en meget tidlig diagnose.
Figuren af proteinet sortilin i høj opløsning
Yderligere oplysninger
For yderligere oplysninger kontakt Claus Munck Petersen, Institut for Medicinsk Biokemi, Aarhus Universitet (cmp@biokemi.au.dk), mobiltelefonnr. 8942 2865 eller Søren Thirup, Molekylærbiologisk Institut, Aarhus Universitet (sth@mb.au.dk), mobiltelefonnr. 6110 9126.
Link til artiklen publiceret i Nature Structural and Molecular Biology:
Ligands bind to Sortilin in the tunnel of a ten-bladed ![]() -propeller domain
-propeller domain
Esben M Quistgaard1, Peder Madsen2, Morten K Grøftehauge1, Poul Nissen1, Claus M Petersen2 & Søren S Thirup1
- MIND Centre, Department of Molecular Biology, University of Aarhus, Gustav Wieds Vej 10C, DK 8000 Århus C, Denmark.
- MIND Centre, Institute of Medical Biochemistry, University of Aarhus, Ole Worms Allé 1170, DK 8000 Århus C, Denmark.
